
服务热线

ClinTransl Med. ||铭泰佳信活体脑化学助力帕金森研究新进展:电针刺激揭示帕金森病治疗新机制
近日,首都医科大学神经病学王晓民实验室贾军老师及其团队在Clinical and Translational Medicine杂志发表题为:“Corticostriatal glutamate-mediated dynamic therapeutic efficacy of electroacupuncture in a parkinsonian rat model.”的文章。本文研究揭示了EA刺激在6-OHDA诱导的帕金森病大鼠模型中具备调节皮质纹状体突触可塑性和降低皮质纹状体部位谷氨酸浓度异常升高的能力。本文为研究皮质纹状体谷氨酸能回路的调节机制与PD患者运动功能障碍的相关性提供了新的视角,为帕金森病的治疗提供了理论依据。
铭泰佳信·未来科技
帕金森病(PD)是一种常见的神经系统退行性疾病,年龄是影响帕金森病发生最主要的因素。帕金森病的临床症状有运动功能障碍,具体表现是运动迟缓、静止性震颤,肌强直,姿势平衡障碍,步态异常等,帕金森病运动功能障碍的发生与黑质多巴胺能神经元的丢失和路易小体的形成有关。相关研究表明,在黑质纹状体DA功能未恢复的情况下,慢性高频电针(EA)刺激可有效改善PD模型动物的运动功能障碍。然而,EA刺激对PD的具体影响和潜在机制目前仍不清楚。文中研究人员首先通过行为学实验比较了EA刺激的频率,刺激部位对6-OHDA诱导的帕金森模型大鼠运动能力的影响,找到了最佳的EA刺激方式,EA刺激的第2-4周,帕金森模型大鼠运动障碍出现明显的好转,四周后停止EA刺激,持续观察效果到第6周开始逐渐下降,至第10周对运动障碍毫无影响,表明EA刺激改善6-OHDA诱导的帕金森模型大鼠运动障碍具有明显的时间依赖性。随后免疫组化结果显示,EA刺激并不会恢复6-OHDA诱导的帕金森模型大鼠黑质纹状体DA能神经细胞的数量。为了进一步确证实验结果的可靠性,研究人员通过活体电化学系统(北京铭泰佳信科技有限公司提供)检测无损伤侧的纹状体部位不同深度下高钾刺激所引起DA的释放,损伤侧的纹状体部位接收高钾刺激,均没有DA的释放,说明损伤侧纹状体DA的释放不受EA刺激的影响。以上结果表明EA刺激并不能恢复黑质纹状体DA能神经元功能。高效液相色谱检测结果表明6-OHDA诱导的帕金森病大鼠模型的中脑和纹状体部位DA浓度不会受EA刺激的影响(结果见图1L)。活体脑化学物质实时分析系统的应用,协助客户验证了实验猜想。搭配上微透析-液相检测体系,两个方案的联合使用极大的提高了实验结果的可靠性,也极大的丰富了神经科学研究者的视角,为后续该设备在神经科学研究上的应用奠定了良好的根基。
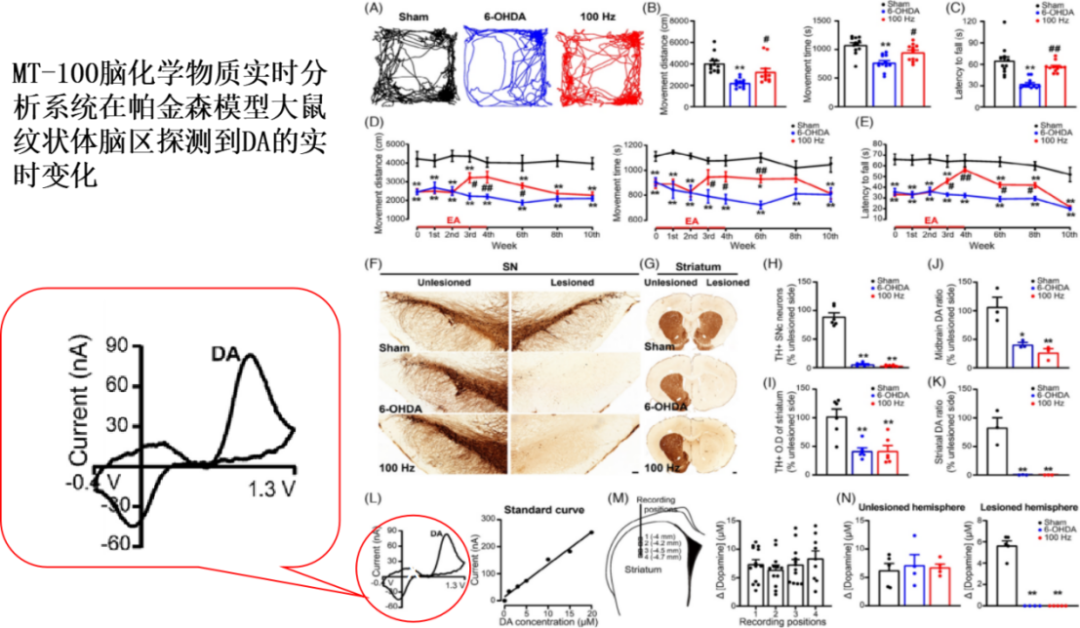
图1.电针(EA)刺激动态改善帕金森模型大鼠的运动功能障碍,并不能改善黑质纹状体多巴胺功能障碍。
进一步,作者通过免疫荧光染色技术观察囊泡谷氨酸转运蛋白(vGluT 1)的密度,发现6-OHDA诱导的帕金森模型大鼠皮质纹状体轴突末端的密度会升高,依靠高尔基体浸渍技术,6-OHDA诱导的帕金森模型大鼠的神经元中观察到树突分支的数量减少,但是这种减少可被100 Hz EA刺激逆转,EA刺激帕金森模型大鼠组总树突长度和分支数目有明显的升高,突触的结构受EA刺激会发生变化。电子显微镜下发现EA刺激导致帕金森模型大鼠皮质纹状体谷氨酸能神经元轴突末端尺寸变小。通过微透析活体采样技术结合高效液相电化学检测结果发现6-OHDA诱导的帕金森模型大鼠背侧纹状体部位谷氨酸浓度异常升高,在EA刺激下会有所改善,以上结果表明了电针(EA)刺激有效地调节帕金森模型大鼠皮质纹状体突触可塑性,使异常升高的谷氨酸浓度降低。

图2:电针(EA)刺激有效地调节帕金森模型大鼠皮质纹状体突触可塑性,使异常升高的谷氨酸浓度降低。
接下来,为了评估EA刺激的动态治疗效果,我们在运动皮层和背外侧纹状体中使用长期植入的电极进行了同步记录。DA缺失导致纹状体和皮质观察到过度同步β振荡,EA刺激能改善这一症状。
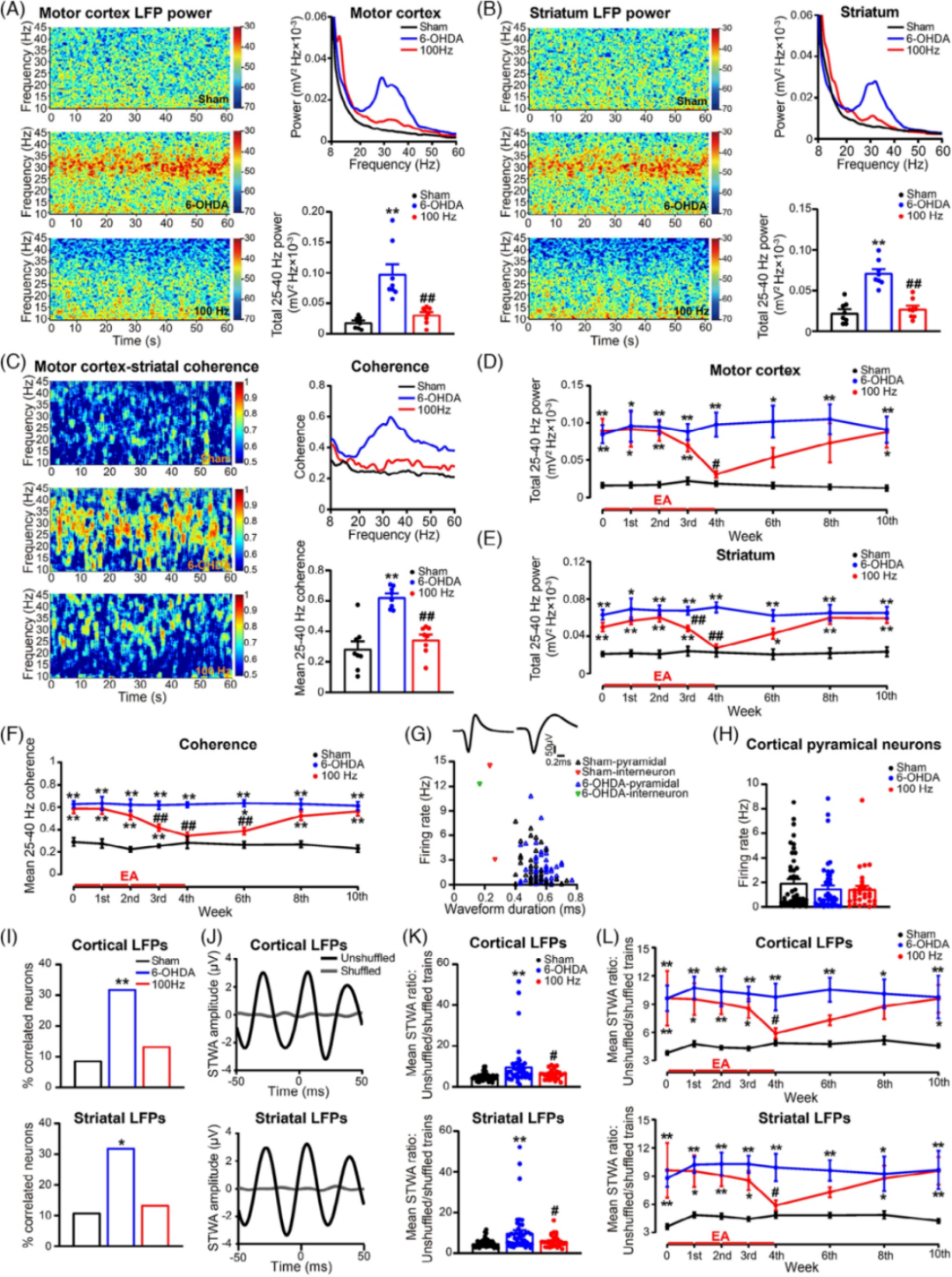
图3.电针(EA)刺激动态调节帕金森模型大鼠皮质纹状体过度同步β振荡。
为了研究皮质纹状体谷氨酸能神经元对帕金森模型大鼠的影响,作者通过化学遗传技术在6-OHDA诱导的帕金森模型大鼠中表达了由专门药物激活的hM4Di(DREADD)的抑制性受体,选择性抑制皮质纹状体谷氨酸能神经元的兴奋性。后续结合行为学分析,微透析-HPLC-ECD检测,在体多通道电生理等技术,证实了选择性抑制皮质纹状体谷氨酸能神经元可以改善6-OHDA诱导的帕金森模型大鼠的过度同步β振荡和运动障碍,降低纹状体异常升高的谷氨酸浓度。
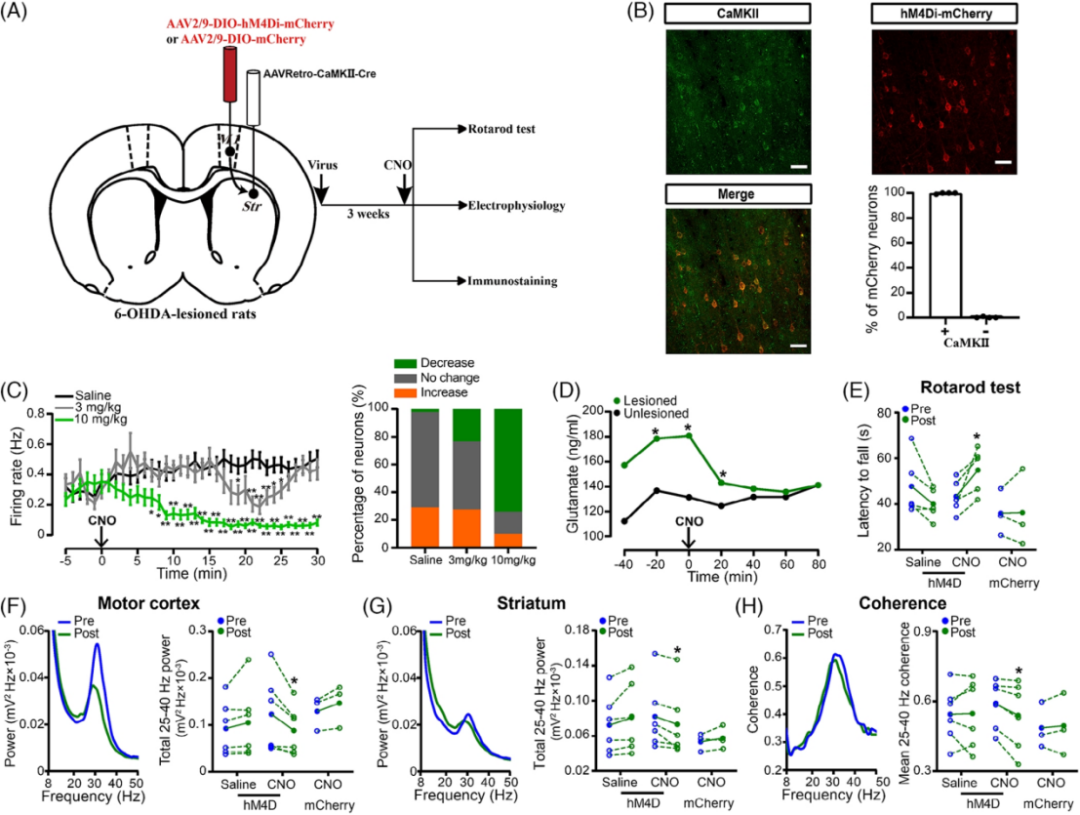
图4:选择性抑制皮质纹状体谷氨酸能神经元可以改善6-OHDA诱导的帕金森模型大鼠的过度同步β振荡和运动障碍,降低纹状体异常升高的谷氨酸浓度。
为了进一步阐明皮质纹状体谷氨酸能神经元在EA刺激治疗 6-OHDA诱导的帕金森模型大鼠中的作用,作者通过化学遗传技术激活6-OHDA诱导的帕金森模型大鼠皮质纹状体谷氨酸能神经元来逆转EA刺激的影响。
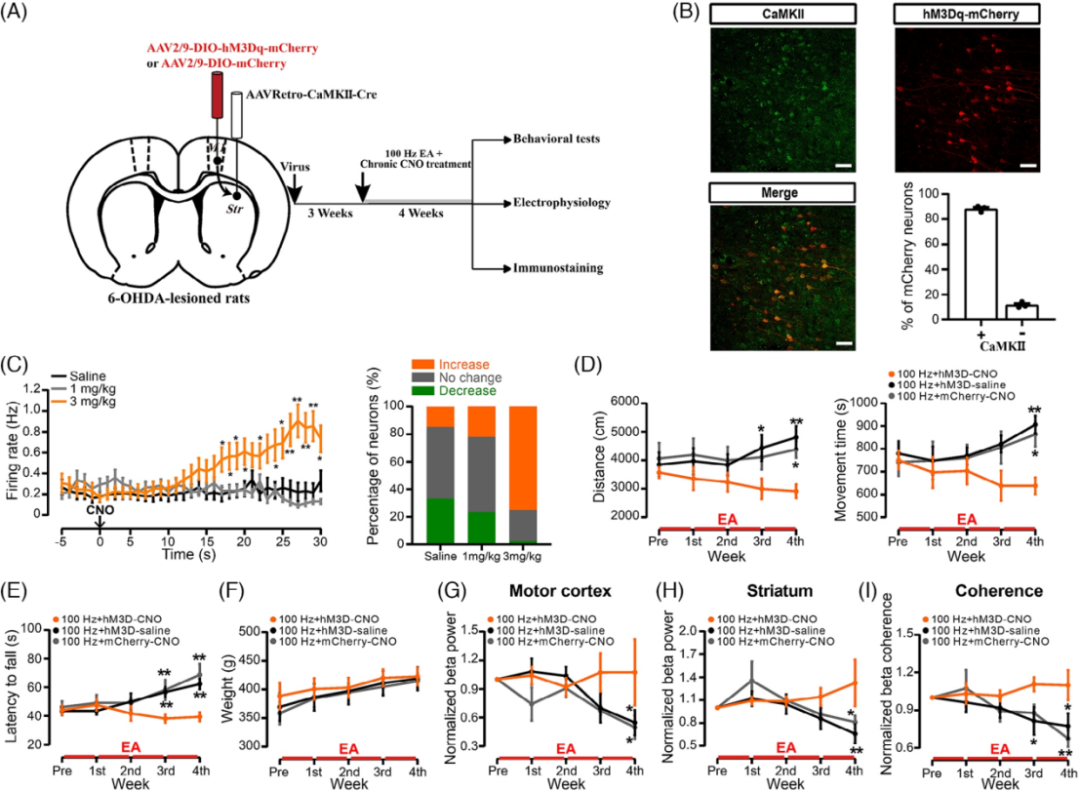
图5:激活6-OHDA诱导的帕金森模型大鼠皮质纹状体谷氨酸能神经元逆转EA刺激的影响。
越来越多的证据表明,EA 刺激通过多种方法对多巴胺能神经元提供神经保护作用。这些作用包括抗神经炎症、抗氧化应激和抗凋亡反应,以及调节肠道微生物组。
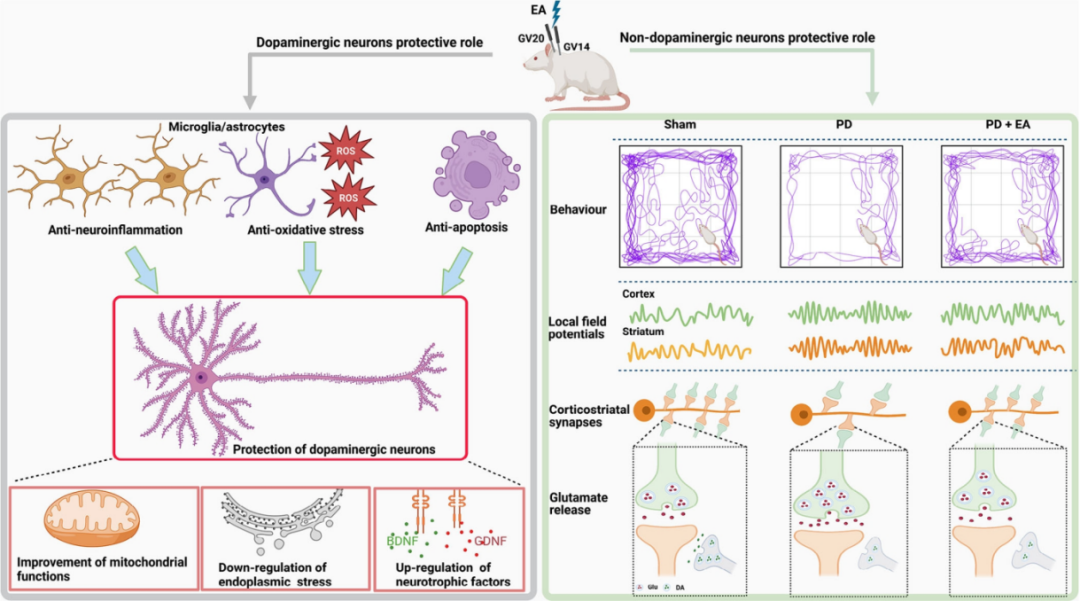
图6:左图说明了 EA 干预通过各种机制对多巴胺能神经元的神经保护作用,右图显示选择性抑制皮质纹状体谷氨酸能神经元可以改善6-OHDA诱导的帕金森模型大鼠的过度同步β振荡和运动障碍,降低纹状体异常升高的谷氨酸浓度。
结论:
总之,本文揭示了EA刺激可以动态地改善帕金森模型大鼠的运动障碍,这种改善与黑质致密部DA功能的恢复无关。EA 刺激调节了皮质纹状体突触可塑性,使帕金森模型大鼠异常升高的谷氨酸浓度降低。EA 刺激有效改善皮质纹状体过度同步β振荡。本文的研究使EA 治疗在帕金森模型大鼠中展现了更多的可能。
北京铭泰佳信科技有限公司的系列设备为该研究做出贡献:
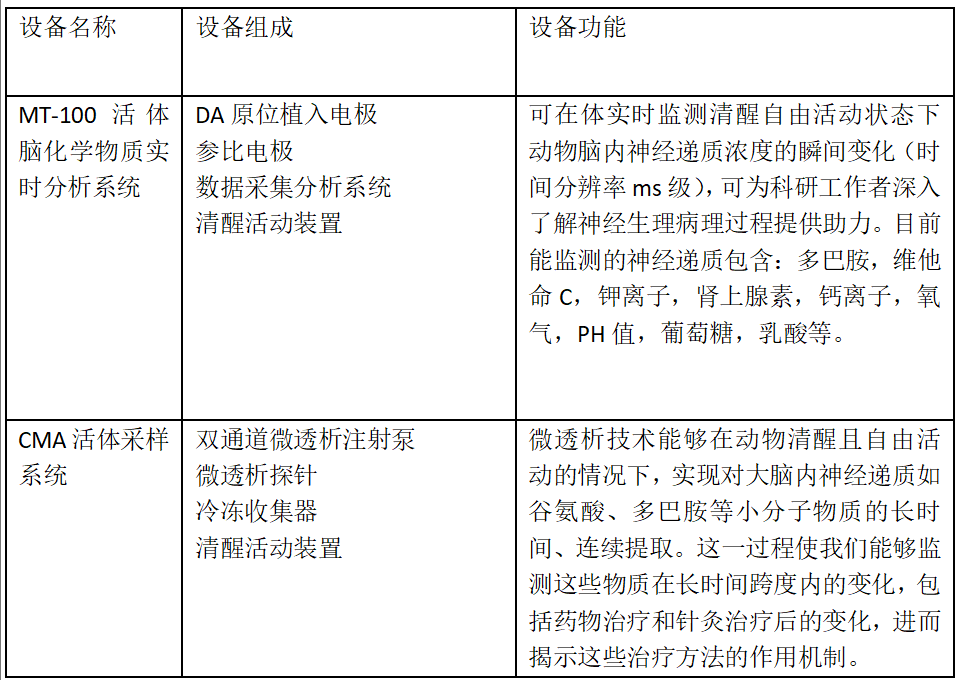
活体脑化学物质实时分析系统
PART.1活体脑化学物质实时分析系统

活体脑化学物质可实时监测清醒自由活动状态下动物脑组织液中化学物质的瞬间变化,可实时的监测给药,光刺激,电刺激,行为学对脑部化学物质的影响程度。

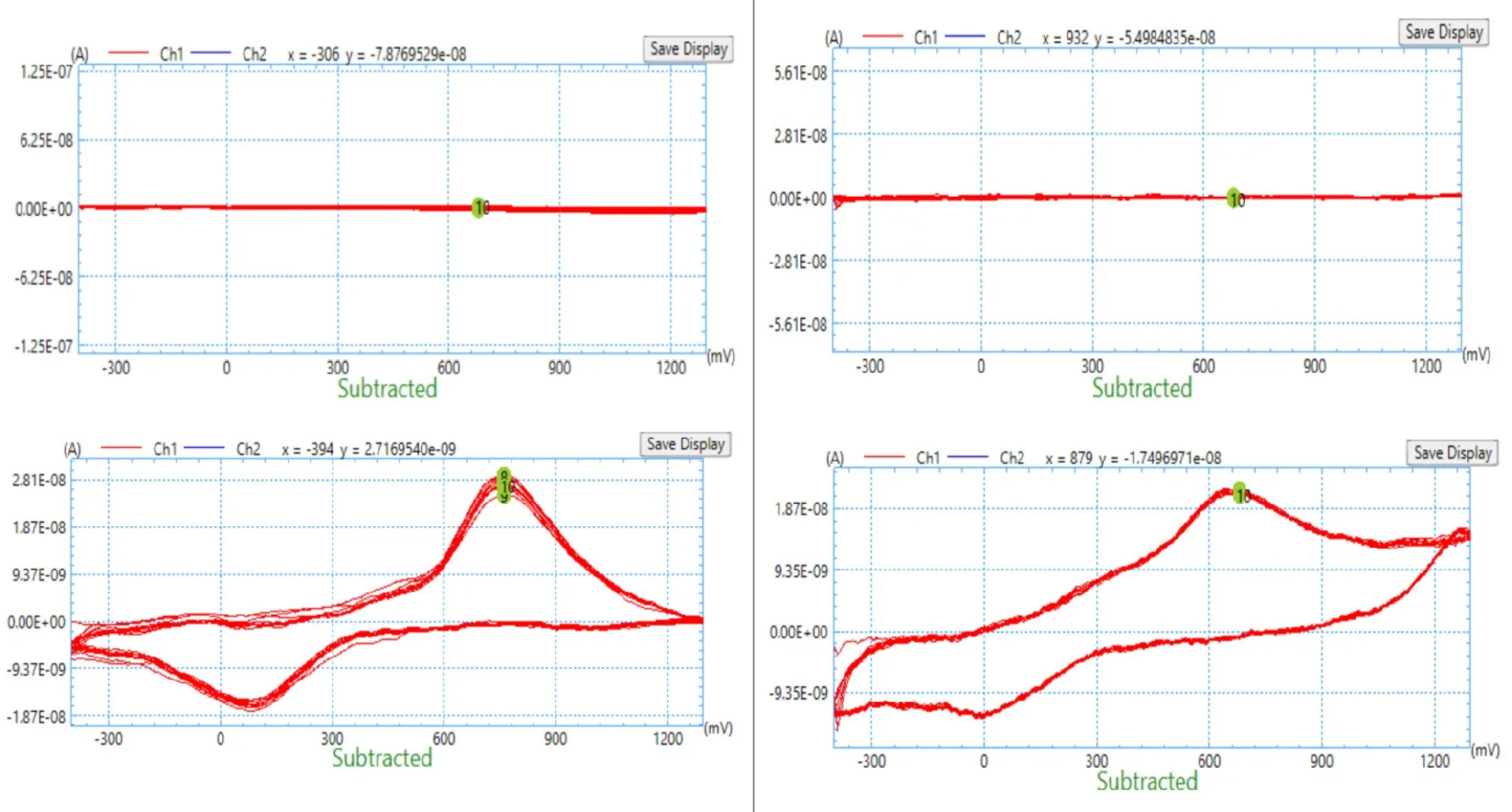
1、电极原位检测(时间分辨率ms级)
实现原位检测的物质:多巴胺,抗坏血酸,肾上腺素,过氧化氢,硫化氢,氧气,钾离子,钙离子,镁离子,pH值
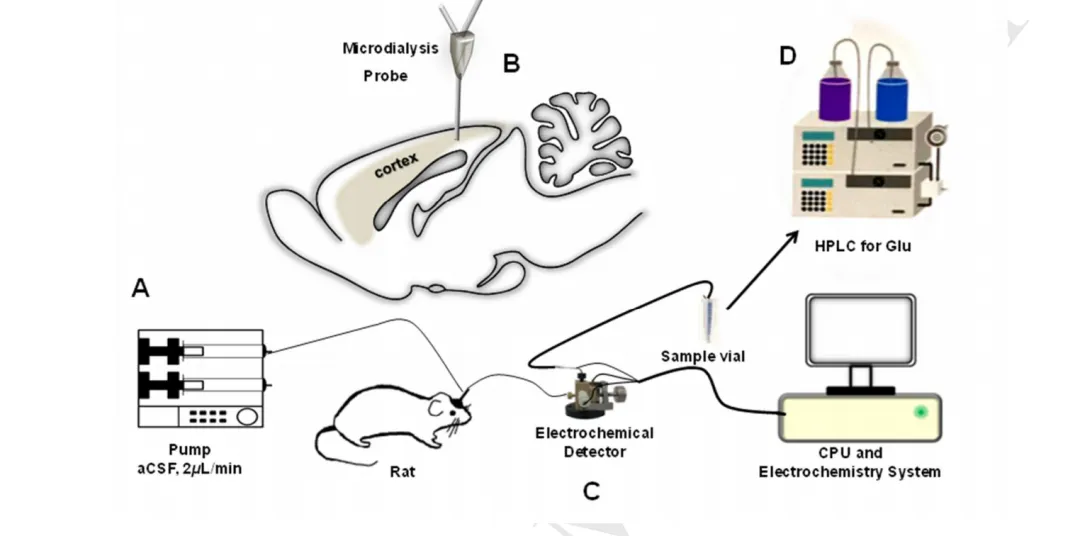
2、结合微透析实现离体在线检测
时间分辨率:分钟级
可检测的物质:抗坏血酸,镁离子,葡萄糖,乳酸