
服务热线

撰文︱蒲添翼
审阅︱李洪忠
责编︱王思珍
来源|逻辑神经科学
神经系统作为机体的“指挥中枢”,其功能远超出传统认知中的运动与感觉调控。近年研究揭示,神经-免疫互作通过多层次对话机制,包括局部神经支配、系统神经内分泌调节,深度参与肿瘤发生发展的全过程。这一发现颠覆了传统肿瘤微环境(TME)理论框架——过去研究虽详尽解析了免疫细胞、间质细胞与肿瘤细胞的互作网络,却长期低估了神经组分在其中的核心调控地位。
重庆医科大学附属第一医院李洪忠/任国胜团队在Signal Transduction and Targeted Therapy正式发表了题为“Neuro-immune crosstalk in cancer: mechanisms and therapeutic implications”。从神经系统对免疫系统的调控,肿瘤微环境中的神经免疫环路,中枢神经系统肿瘤中的神经-免疫互作,外周肿瘤中的神经-免疫互作,压力、节律、脑肠轴对肿瘤免疫微环境的影响,肿瘤免疫对神经系统的作用以及靶向神经免疫调控的肿瘤治疗等多个方面,系统阐述了神经-免疫-癌症轴的分子互作网络及其调控机制,为靶向神经免疫调控在癌症治疗中的应用提供了新视角。

一、免疫器官的神经支配及调控肿瘤免疫微环境的神经环路
传统观点认为神经系统与免疫系统相互独立,但最新研究揭示,它们通过淋巴及造血器官(如淋巴结、脾脏、骨髓、胸腺)的神经支配形成紧密互作网络。解剖学研究表明,淋巴组织密集分布着感觉神经(如含CGRP的纤维)和自主神经,其中交感神经通过NE/β1/β2受体轴调控免疫细胞功能,而脾脏的副交感神经支配机制也被证实(图1)。
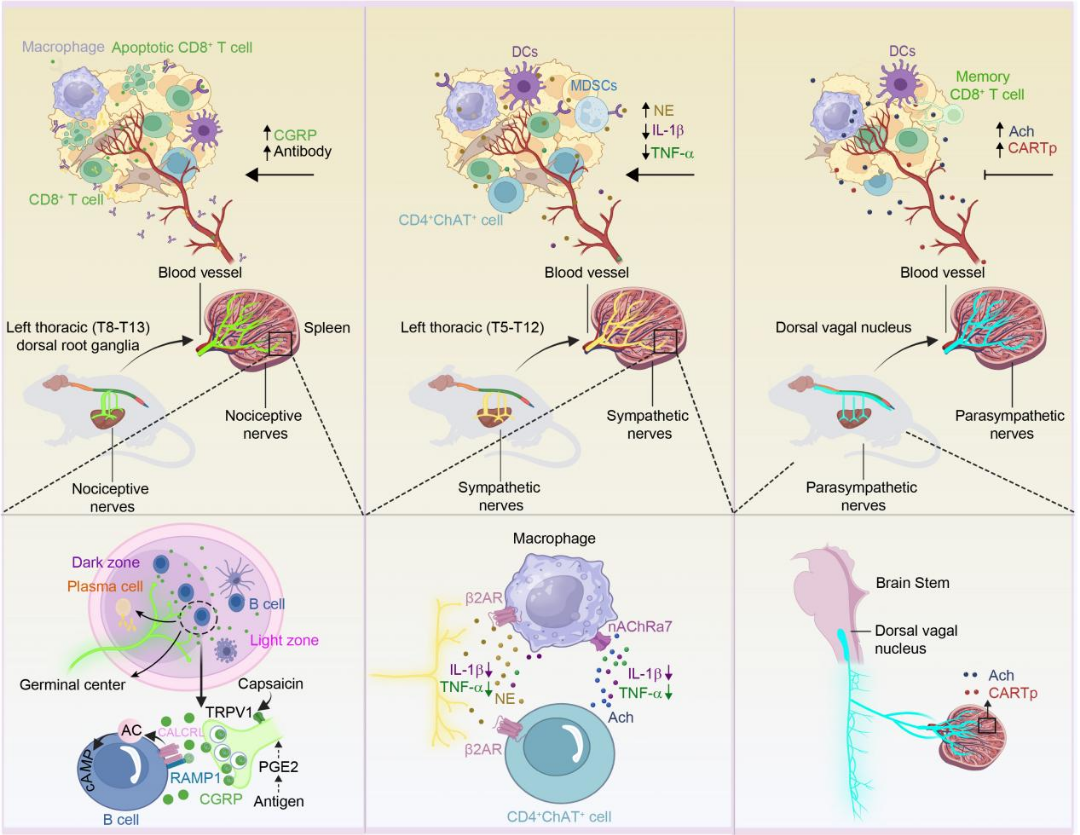
图1脾脏的神经支配
在神经免疫调控环路中,外周炎症可激活岛叶皮层(InsCtx)神经元[1],进而通过迷走神经背核(DMV)调节炎症反应。同时,迷走神经可感知炎症信号并上传至孤束核的(cNST)和后区(AP),其中CRH神经元通过交感神经驱动TME的免疫重塑[2]。例如,在乳腺癌模型中,杏仁核中央区(CeA)的CRH神经元激活可显著促进TME内交感神经的异常增殖,而药物阻断该通路可抑制肿瘤进展。需注意的是,不同组织(如皮肤、肌肉、内脏)的神经分布存在显著空间异质性,导致调控环路呈现组织特异性特征。未来需借助谱系追踪和神经环路特异性操控技术(如化学遗传学、光遗传学)进一步验证这些环路,将为靶向神经-免疫治疗提供新的干预策略(图2)。
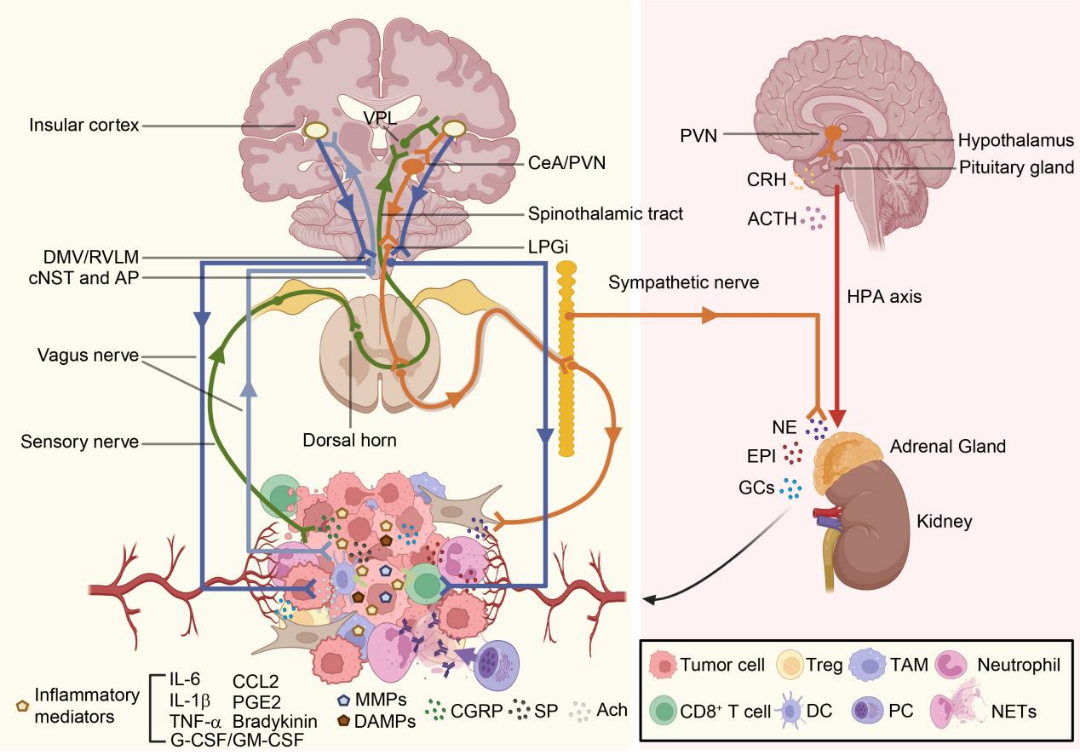
图2调控肿瘤免疫微环境的神经环路
二、免疫器官的神经支配及调控肿瘤免疫微环境的神经环路
最新研究表明,硬脑膜淋巴系统、脑膜免疫细胞群及颅骨骨髓来源的髓系细胞共同构建了中枢神经系统独特的外周免疫监视机制。在胶质瘤微环境中,肿瘤相关巨噬细胞(TAMs)通过糖酵解-PERK-ATF4信号通路的激活诱导组蛋白乳酰化修饰,进而增强免疫抑制性细胞因子IL-10的表达。同时,神经元电活动通过释放midkine等神经营养因子,激活CCL4-CCL5趋化因子轴,促进肿瘤恶性进展[3]。这一复杂的调控网络整合了神经元电活动、免疫细胞功能极化和代谢重编程等多个关键生物学进程,并在不同脑区表现出明显的空间异质特征。深入解析这一网络的分子机制和组织特异性,将为发展基于免疫微环境调控的新型中枢神经系统肿瘤治疗策略提供重要理论基础(图3)。
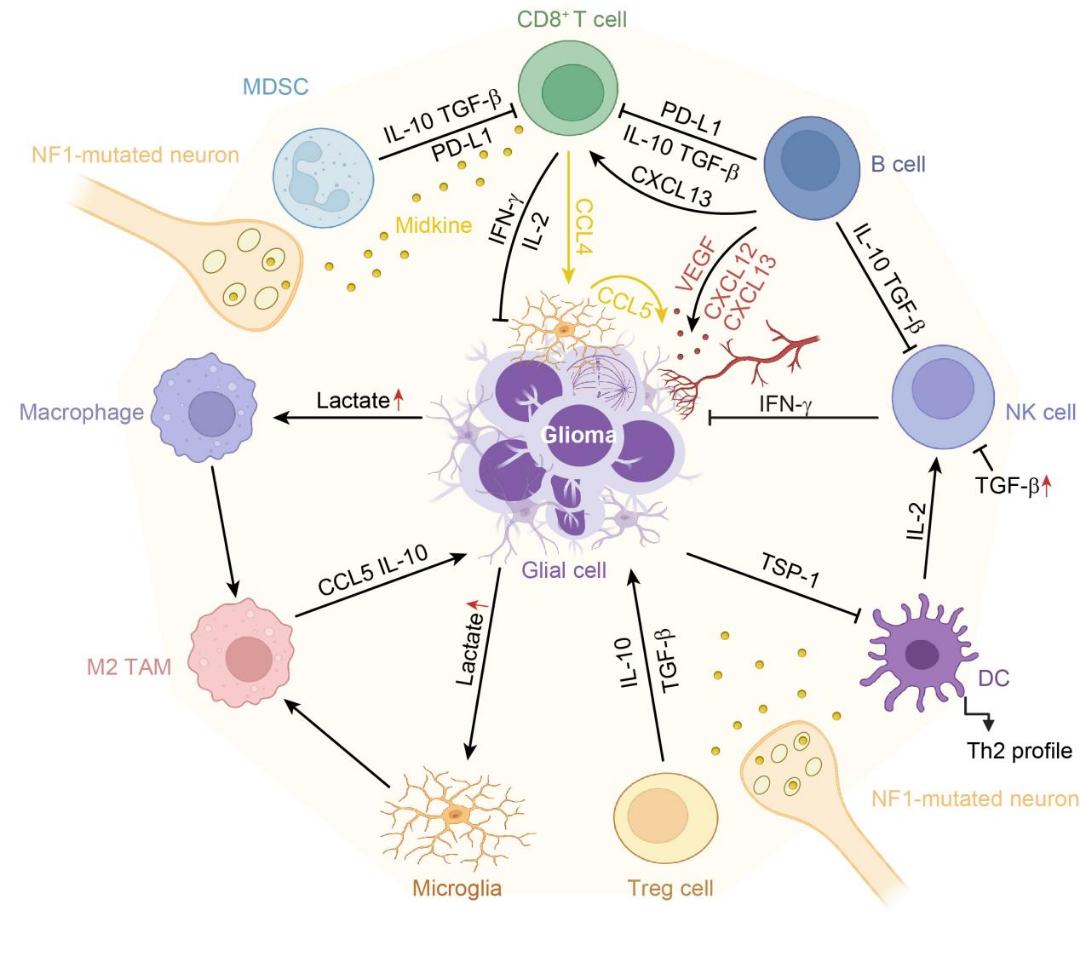
图3中枢神经系统肿瘤中的神经-免疫互作
外周神经系统通过感觉神经、交感神经、副交感神经及胶质细胞-免疫轴的动态互作,在肿TME中发挥多重调控作用。感觉神经释放的P物质(SP)和降钙素基因相关肽(CGRP)通过NK-1R/RAMP1受体信号双向调节免疫反应:SP促进炎症但驱动甲状腺癌进展,CGRP通过抑制NF-κB和M1巨噬细胞极化增强免疫抑制[4],其RAMP1+CD8+T细胞高耗竭表型与患者不良预后相关。交感神经递质去甲肾上腺素(NE)经β2-AR-MDSC轴上调PD-L1和ARG1,削弱T细胞功能,而β阻滞剂可逆转此效应[5]。副交感神经通过乙酰胆碱(ACh)-mAchR通路激活TNF-α+巨噬细胞或TFF2+记忆T细胞抑制结直肠癌进展。胶质细胞(如施万细胞)以CCL2依赖方式招募M2型TAM和MDSC,而神经递质(GABA/5-HT/多巴胺)分别通过β-catenin、PD-L1表观修饰及DRD5-CD103+T细胞分化调控TME免疫平衡。神经内分泌肿瘤(如小细胞肺癌)中高耗竭T细胞浸润提示靶向神经-免疫交互网络的联合治疗潜力(图4)。
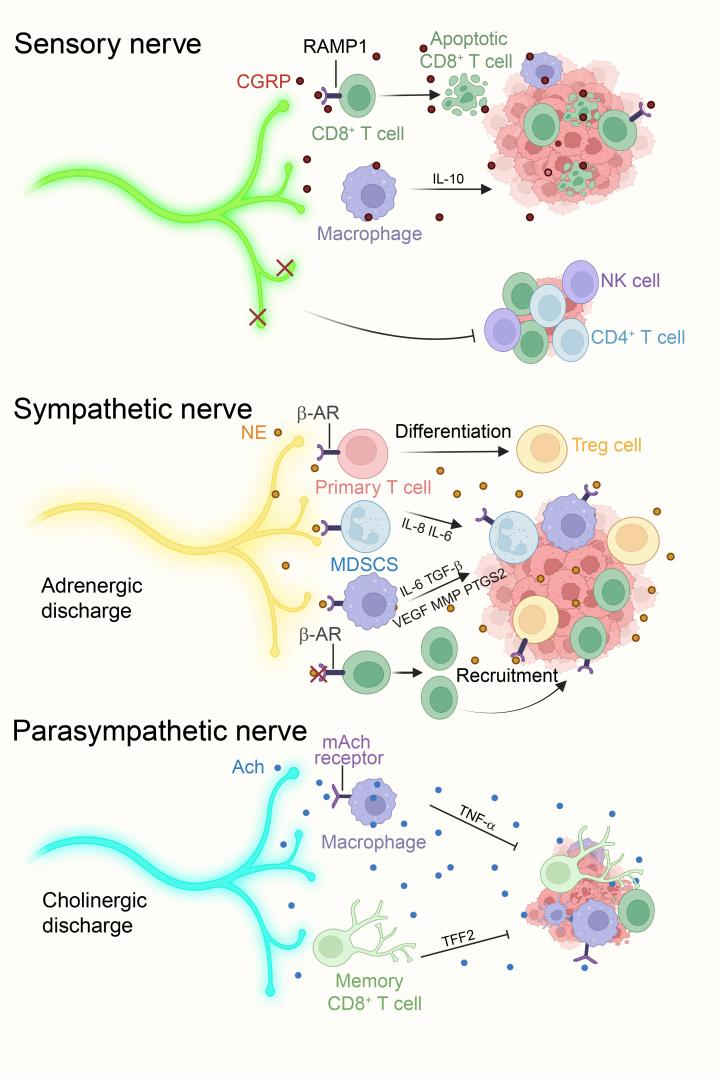
图4周围神经调控肿瘤免疫微环境
三、节律、压力、脑肠轴在肿瘤免疫调控中的作用
昼夜节律通过中枢(SCN)-外周时钟系统精准调控肿瘤免疫。SCN通过VIP/CCK神经元网络协调免疫细胞迁移节律,而时钟基因(BMAL1/CLOCK-PER/CRY-TTFL环路)则调控肿瘤DNA修复、代谢重编程及CSC干性维持[6]。临床证据显示,节律紊乱可升高乳腺癌/NSCLC转移风险,其机制涉及时钟基因(如GBM中CLOCK趋化小胶质细胞、黑色素瘤BMAL1缺失诱导TAMs极化)通过PD-L1/CTLA-4等通路促进T细胞耗竭。靶向干预策略包括:RORγ/RORα激动剂增强Th17/CD8+T细胞功能,时序化ICIs给药(如晨间抗PD-1),以及节律同步化放化疗。未来需解析中枢-外周节律互作网络,以优化时序免疫治疗(图5)。
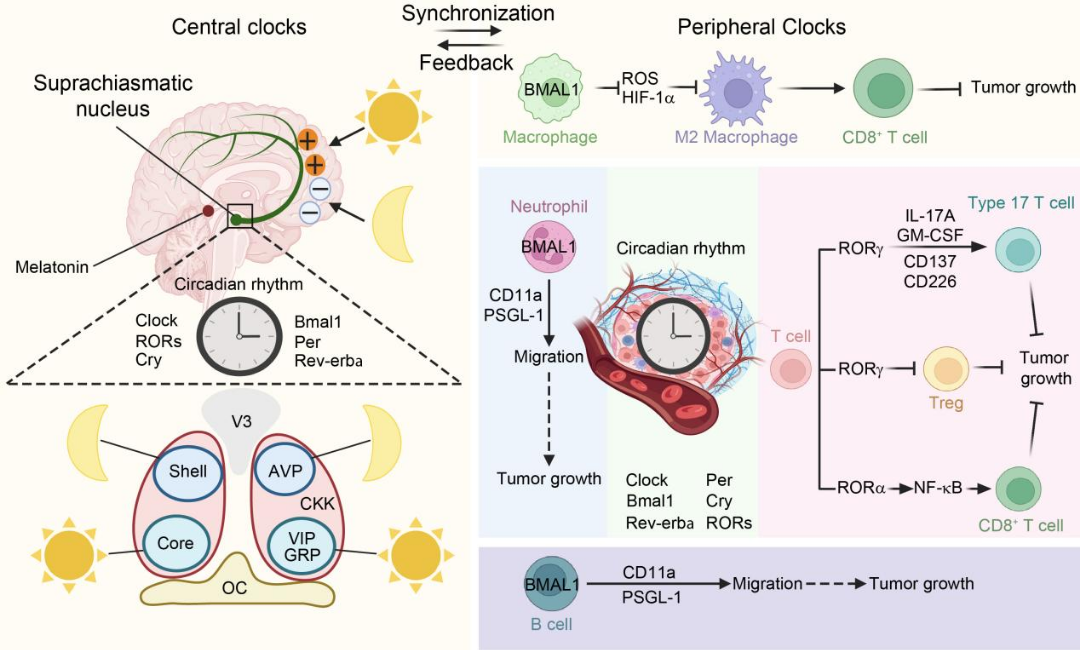
图5节律对肿瘤免疫微环境的调控
慢性压力激活交感神经系统(SNS)和下丘脑-垂体-肾上腺轴(HPA轴),导致儿茶酚胺(如NE、DA)和糖皮质激素(GCs)释放增加。这些分子通过受体依赖的信号通路(如β2-AR、GR)调控免疫细胞功能:GCs通过上调TCF1抑制CD8+T细胞抗肿瘤活性,并与黑色素瘤免疫治疗失效相关;NE通过β2-AR-NR4A1轴促进T细胞功能失调,同时诱导TAMs/MDSCs代谢重编程(增强氧化磷酸化/PGE2分泌)[6]。表观遗传学研究发现,压力诱导的乳酸积累可驱动组蛋白乳酸化,促进TAMs向促瘤表型转化,而高血糖应激增强O-GlcNAc糖基化,加剧M2型巨噬细胞极化。临床干预策略包括β-AR拮抗剂(如普萘洛尔)联合PD-1抑制剂以恢复T细胞功能,以及GR拮抗剂(如米非司酮)改善免疫微环境。未来研究需阐明压力介导的时空特异性免疫代谢调控,并基于TSC22D3/皮质醇等生物标志物优化精准治疗(图6)。
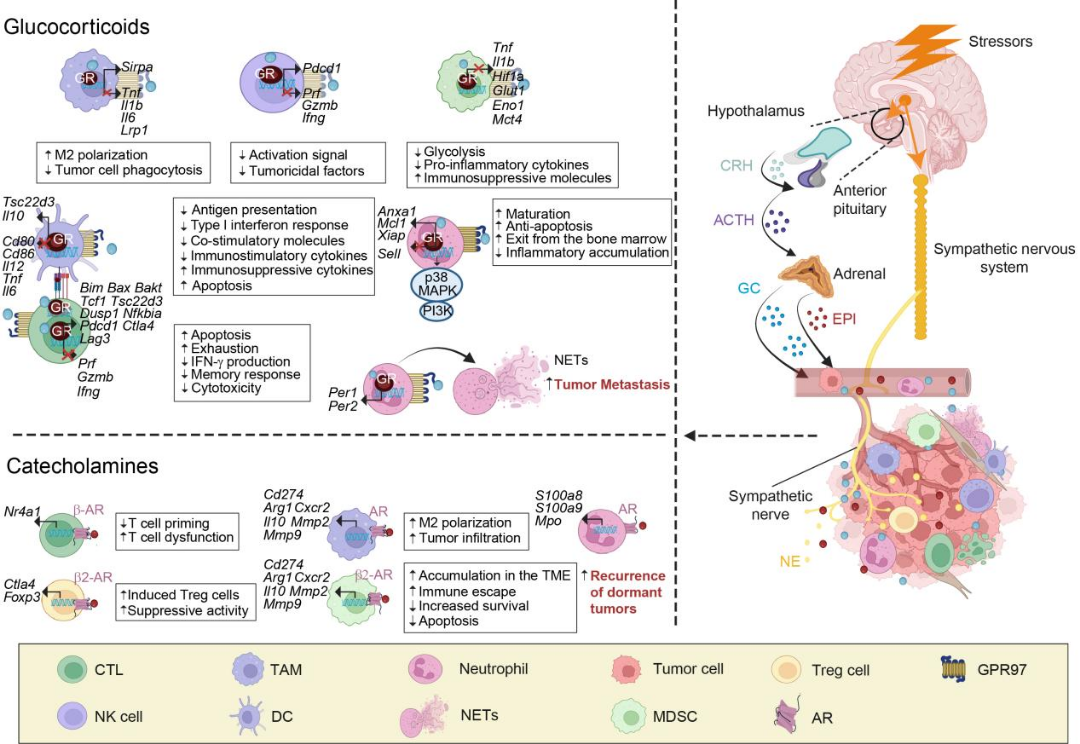
图6压力对肿瘤免疫微环境的调控
作为连接中枢神经系统与肠道菌群的复杂网络,肠脑轴通过自主神经系统和微生物代谢物的协同作用精细调控肿瘤免疫微环境。研究发现,肠道菌群紊乱可导致短链脂肪酸(SCFAs)合成减少和FFAR2/3信号通路失调,进而促进结直肠癌的促炎性微环境形成及转移进程[8];而补充SCFAs则能通过增强血脑屏障稳定性并激活小胶质细胞TREM2通路,显著抑制胶质瘤发展。值得注意的是,特定菌群代谢产物(如化合物K、肌苷)可靶向调节免疫检查点分子的表达,提示粪菌移植和益生菌干预或能优化免疫检查点抑制剂的疗效。然而,广谱抗生素导致的菌群失衡会破坏这一免疫调控网络,显著削弱抗肿瘤免疫应答。未来研究应深入解析肠脑轴中菌群-代谢物-免疫轴的特异性作用机制,为开发基于微生物组精准调控的新型抗肿瘤策略提供理论依据(图7)。
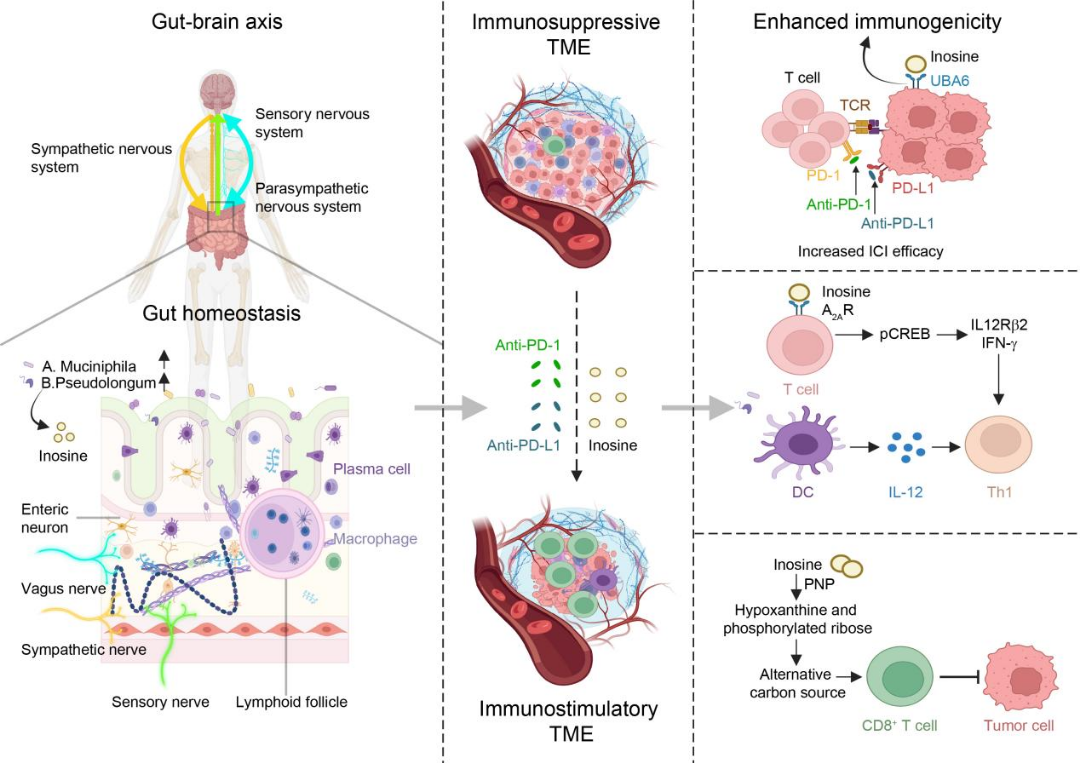
图7神经-免疫调节维持肠道稳态并增强癌症免疫治疗效果
四、节律、压力、脑肠轴在肿瘤免疫调控中的作用
神经周围浸润(PNI)是多种恶性肿瘤(如胰腺癌、头颈癌)预后不良的关键因素,其机制涉及肿瘤相关巨噬细胞(TAM)通过IL-6、TNF等细胞因子介导的神经周围炎症,以及神经营养因子(如artemin/GFRα3)和趋化因子CCL5/CCR5轴驱动的肿瘤-神经互作。TME中低氧、酸中毒及氧化应激可诱导神经炎症和病理性神经可塑性,并通过激活TRPV1/ASIC等伤害性受体及NGF/TrkA通路(上调SP、CGRP等疼痛介质)导致癌症疼痛。副肿瘤性神经系统综合征(PNS)由肿瘤抗原触发的自身免疫反应引起,抗胞内抗原(如Yo抗原)多伴随T细胞介导的神经损伤,而抗胞膜抗原(如AMPA-R、GABA-R)可直接导致受体内化或功能异常[9]。免疫检查点抑制剂(ICIs)可能通过增强CD8+ T细胞毒性及削弱Treg功能引发神经毒性(发生率1%-6%),临床需联合激素或血浆置换干预。未来治疗需整合疼痛管理(靶向炎症通路)、副肿瘤综合征免疫调节(如利妥昔单抗)及肿瘤特异性治疗。
五、靶向神经-免疫互作在肿瘤治疗中的研究进展
TME中的神经-免疫互作已成为癌症治疗新靶点。研究证实,β受体阻滞剂(如普萘洛尔)通过抑制肾上腺素能信号可重塑免疫微环境,表现为CD8+T细胞浸润增加(提升78%抗PD-1响应率)、PD-1表达下调及MDSCs减少,临床前模型显示其与抗CTLA-4疗法具有协同效应。已证实普萘洛尔在黑色素瘤、乳腺癌中可通过免疫调节(如升高IFN-γ/降低IL-6)而非直接细胞毒性发挥作用;钠通道阻滞剂利多卡因虽在乳腺癌中降低MMP3/NETs以抑制转移,却在胰腺癌因干扰胆碱能抑癌通路而失效,凸显靶点特异性重要性。当前局限包括样本量不足及缺乏β-AR表达分层,未来需结合病理检测精准筛选受益人群。探索性试验正拓展至纳多洛尔(长效β阻滞剂)、多奈哌齐(AchE抑制剂)及CGRP抗体(如Erenumab)等新型神经调节剂,其机制涉及调控T细胞功能、神经递质平衡及昼夜节律通路。神经免疫治疗的临床转化亟待通过多组学分析阐明神经-免疫-肿瘤三方互作网络,并建立生物标志物指导的个体化治疗策略。
六、总结与展望
尽管神经组分在TME中与免疫系统的相互作用日益受到关注,但其调控的精确机制仍有待深入探索。研究表明,神经组分通过分泌神经递质(如去甲肾上腺素、乙酰胆碱)和神经肽(如P物质、CGRP)动态调节免疫细胞功能,进而影响肿瘤进展、治疗抵抗及肿瘤相关疼痛的发生。这些神经免疫介质及其受体可能作为潜在的预后标志物或新型治疗靶点。
未来研究应聚焦以下方向:深度解析TME中神经-免疫互作的分子机制特征,开发神经调节联合靶向/免疫治疗的优化方案,并系统评估精神神经类药物(如β受体阻滞剂、抗抑郁药)在肿瘤辅助治疗中的临床价值。然而,该领域仍面临诸多挑战,包括神经/免疫细胞的时空异质性,神经-内分泌-免疫网络的复杂性,临床前模型与人类TME的差异。克服这些挑战将需要整合单细胞多组学技术、先进显微成像和计算生物学方法,并结合跨学科研究,以推动基于神经免疫调控的精准抗肿瘤策略的发展。
原文链接:http://doi.org/10.1038/s41392-025-02241-8
转载须知:未经授权禁止转载,违者必究。