
服务热线

撰文|杨甦团队
责编|王思珍
来源|逻辑神经科学
多聚谷氨酰胺(polyQ)疾病是一类由单基因突变引起的神经退行性疾病。长期以来,已知的polyQ疾病共有九种,包括亨廷顿舞蹈症(Huntington's disease)以及多种脊髓小脑性共济失调(spinocerebellar ataxia,SCA)亚型[1,2]。2023年,研究者鉴定出一种新的SCA亚型——SCA51,被确认为第十种polyQ疾病。该病由编码转录因子THAP11的基因一号外显子中CAG重复序列的扩增突变引起。SCA51患者表现出小脑萎缩,临床症状包括步态不稳、构音障碍等[3]。目前,突变的THAP11如何引发这些病理特征仍尚不清楚。
暨南大学粤港澳中枢神经再生研究院杨甦/李世华和湘雅医院江泓团队在Journal of Clinical Investigation在线发表题为“Mutant THAP11 causes cerebellar neurodegeneration and triggers TREM2-mediated microglial activation in mice”的研究论文。研究团队通过腺相关病毒(AAV)注射和基因敲入技术构建了表达突变THAP11的小鼠模型,发现该突变主要通过获得性功能(gain-of-function)机制,导致小鼠出现小脑特异性神经元死亡。进一步研究表明,突变THAP11通过异常的转录调控激活TREM2信号通路,从而驱动小胶质细胞介导的神经炎症反应并诱发神经元死亡。本研究不仅首次构建了SCA51动物模型,为后续机制研究和药物筛选奠定了基础,也揭示了TREM2介导的小胶质细胞活化在polyQ疾病中的关键作用,为相关疾病的治疗提供了新的潜在靶点。

研究团队首先分析了THAP11在小鼠和食蟹猴的大脑中的表达分布,发现其在小脑这一SCA51核心病变区域中显著富集。这一表达模式在小鼠与灵长类之间高度保守,提示其功能可能具有跨物种的重要性。此外,THAP11的表达水平在脑发育过程中呈现年龄依赖性的下降趋势,但在成年小鼠和猴脑中仍可检测到稳定表达。这一动态表达模式表明,THAP11不仅是早期神经发育的关键调控因子,其功能还可能延伸至成年神经系统的稳态维持。
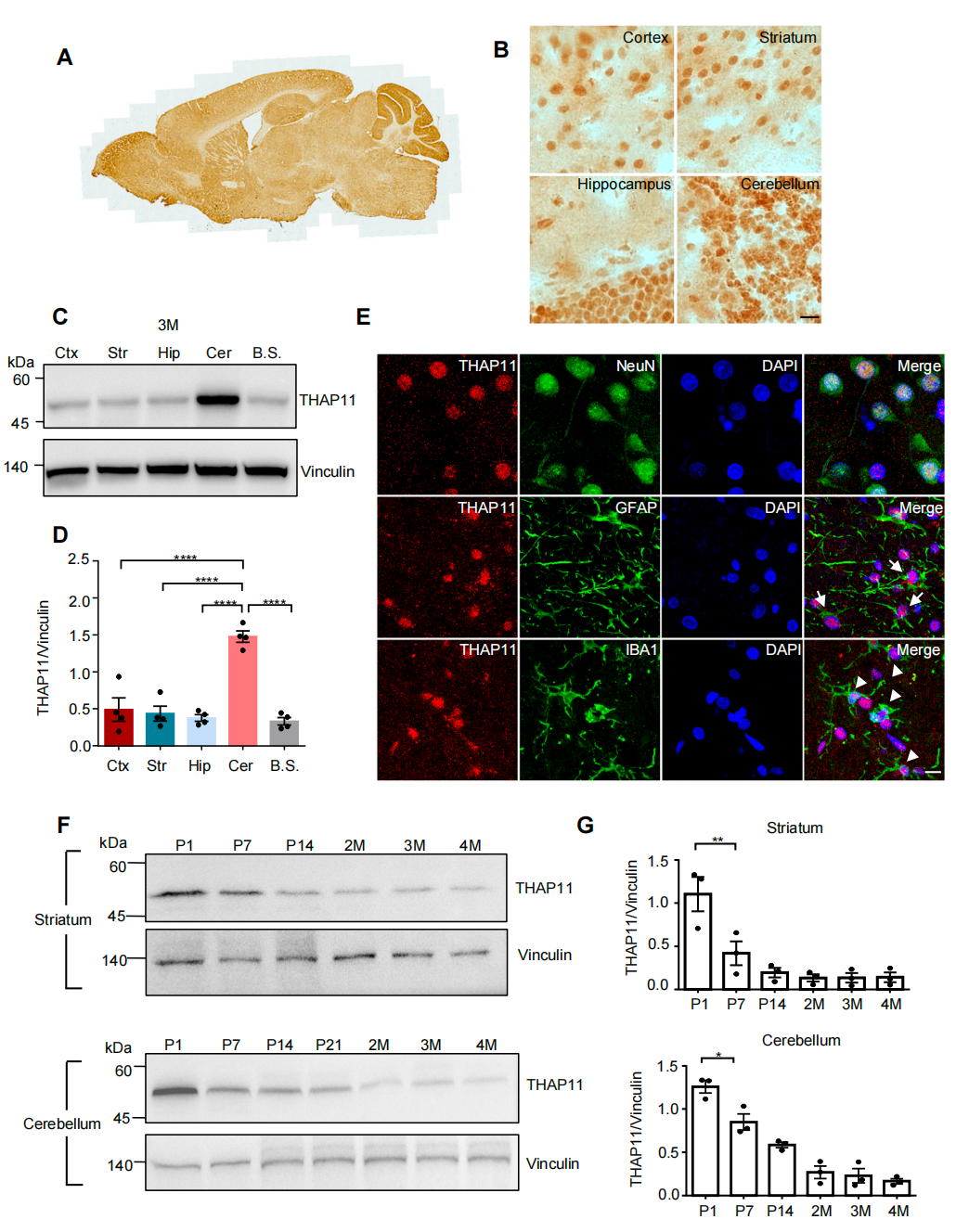
图1.THAP11蛋白在大脑中的表达特征
研究团队采用CRISPR/Cas9基因编辑技术敲低内源性THAP11的表达。发现在成年小鼠的中枢神经系统中,THAP11蛋白的缺失并未引发神经元退行性病变,提示SCA51的致病机制可能并非源于THAP11的功能丧失(loss-of-function),而更可能与其获得性功能异常有关。接着,研究人员利用AAV介导的基因递送技术,在小鼠的小脑和纹状体中分别表达THAP11-29Q和THAP11-47Q,发现突变THAP11-47Q在小脑中形成大量核内聚集体,并诱导小脑浦肯野细胞(Purkinje cell)选择性变性。行为学实验进一步表明,小脑中表达突变THAP11-47Q的小鼠表现出显著的运动功能障碍。
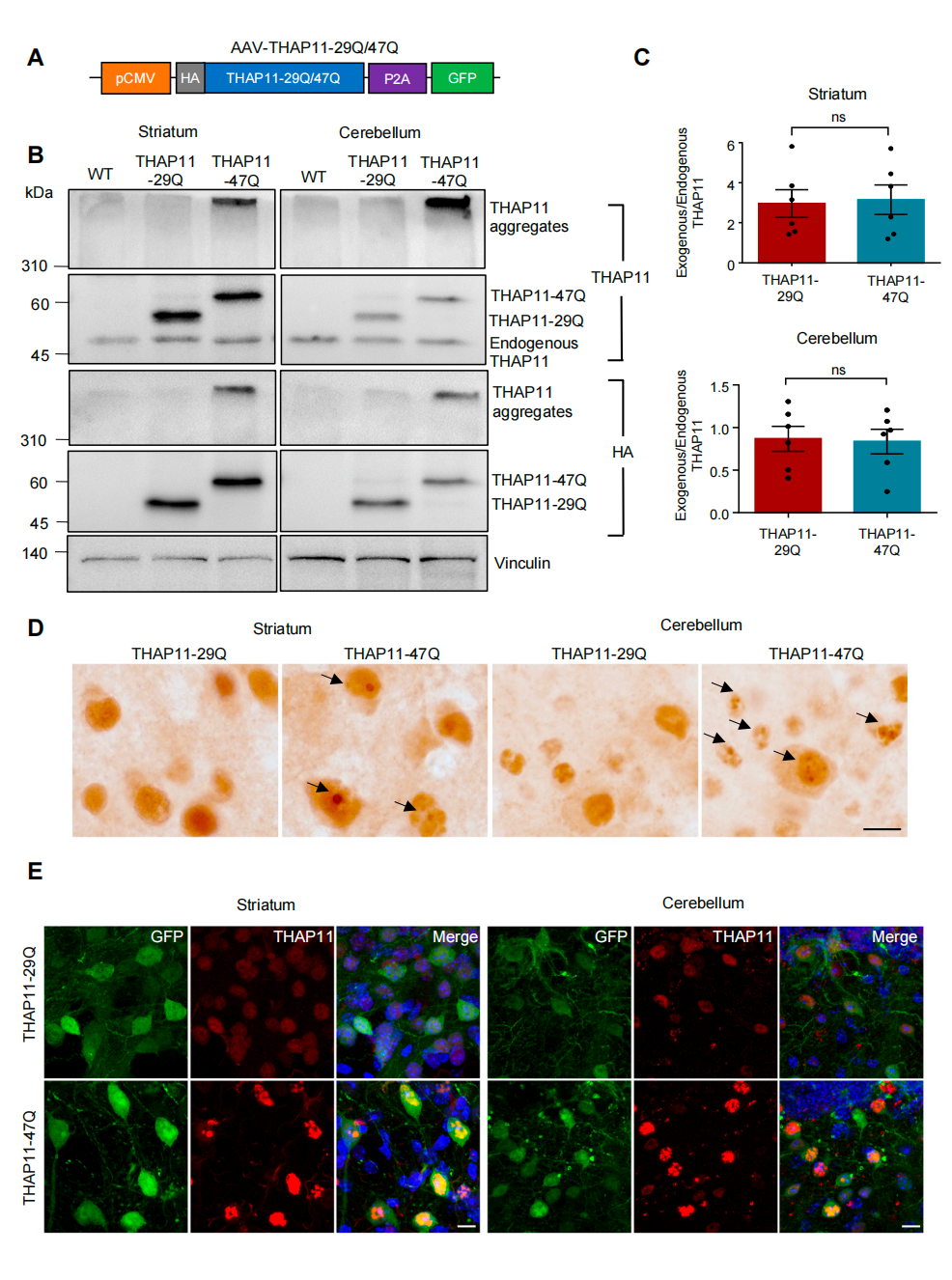
图2.突变THAP11在小鼠脑内形成聚集体
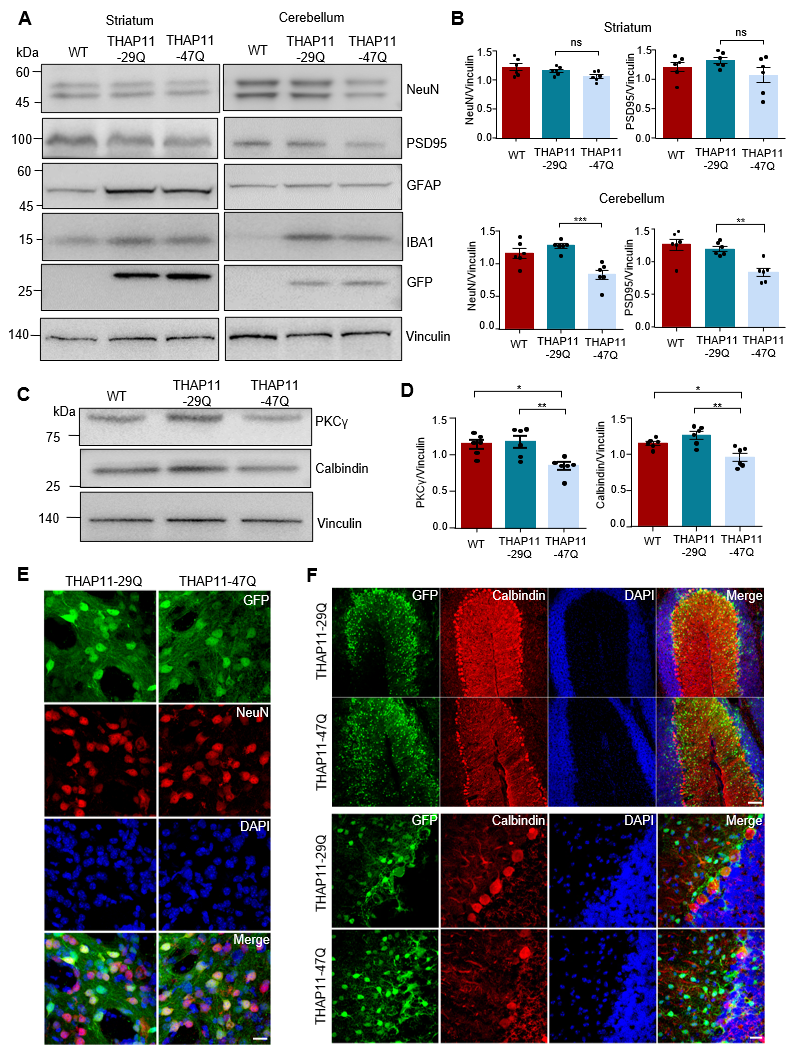
图3.突变THAP11造成小脑特异性神经元损伤
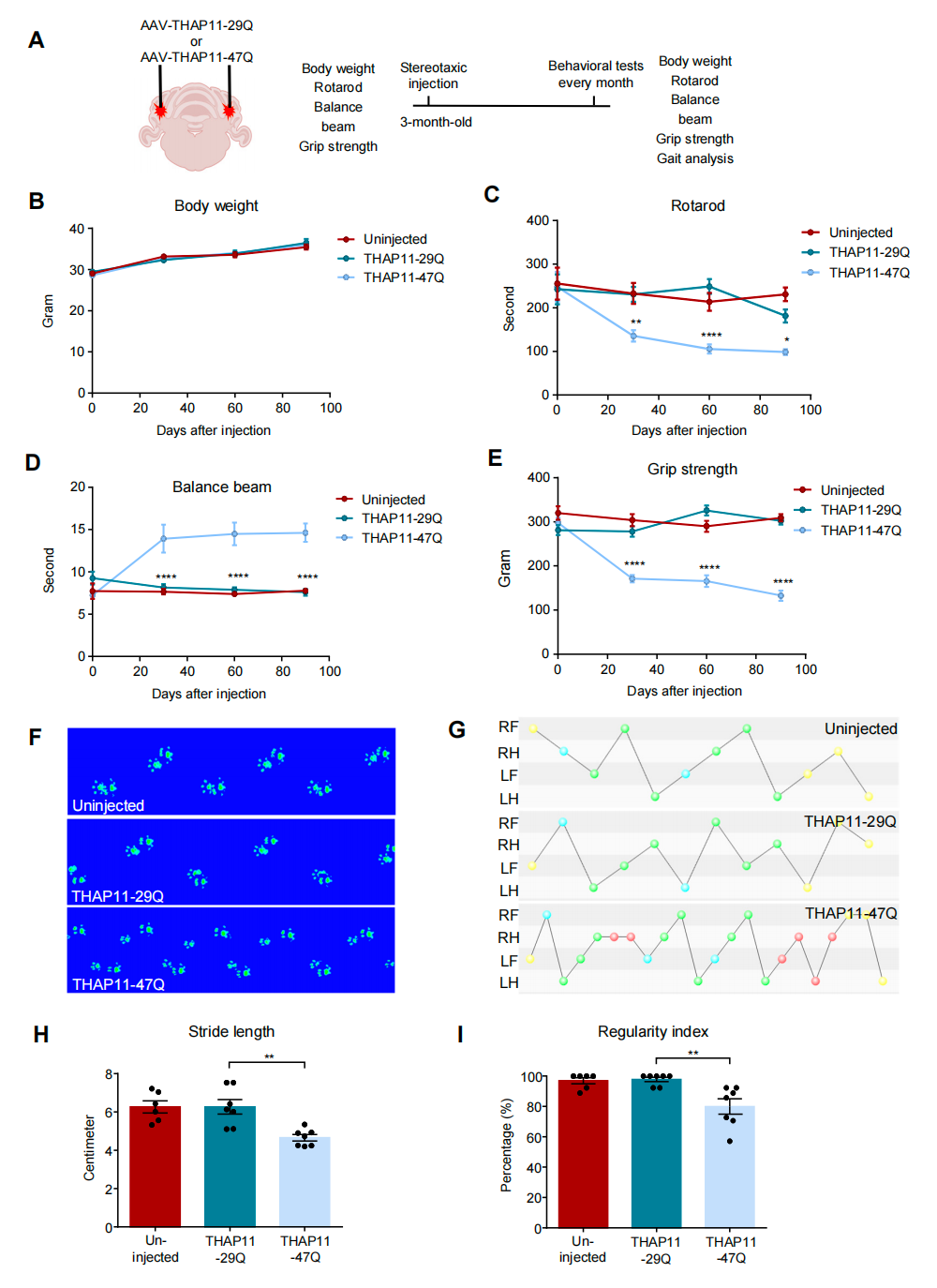
图4.突变THAP11导致小鼠出现运动功能缺陷
然后,研究人员通过RNA测序发现,表达突变THAP11-47Q的小脑样本中,小胶质细胞激活相关基因(如TREM2、C1qA、C1qC、Cle7a)表达显著升高,其中TREM2作为小胶质细胞激活的核心调控因子被重点关注。该现象在新构建的THAP11-47Q基因敲入小鼠模型中得到了验证。
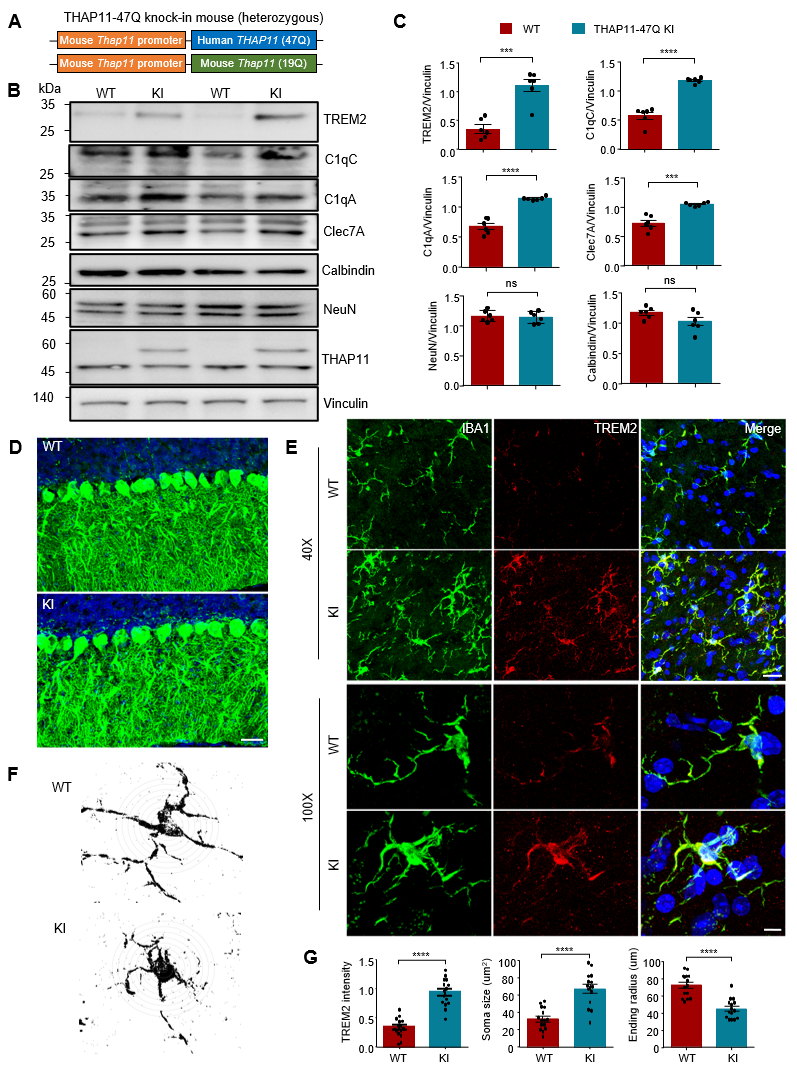
图5.突变THAP11导致小胶质细胞TREM2表达上调并激活
最后,研究人员发现,突变THAP11-47Q通过增强其对TREM2启动子的结合能力,特异性上调TREM2的表达。敲除TREM2基因或使用小胶质细胞清除剂PLX5562可显著缓解突变THAP11导致的神经毒性。这一结果提示,靶向TREM2或小胶质细胞活化通路有望成为治疗SCA51的潜在策略。
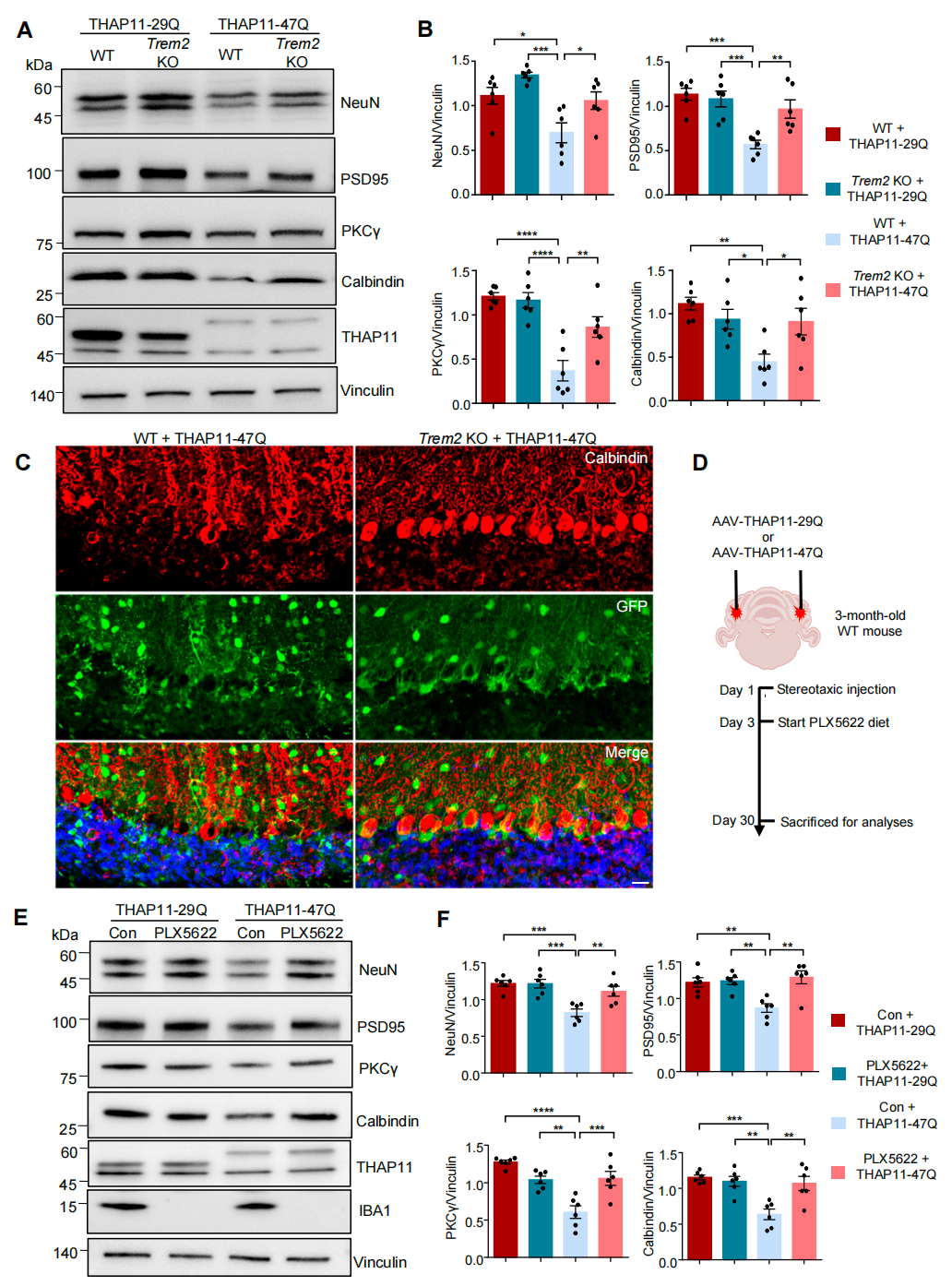
图6.TREM2敲除或清除小胶质细胞可有效缓解变异THAP11的神经毒性
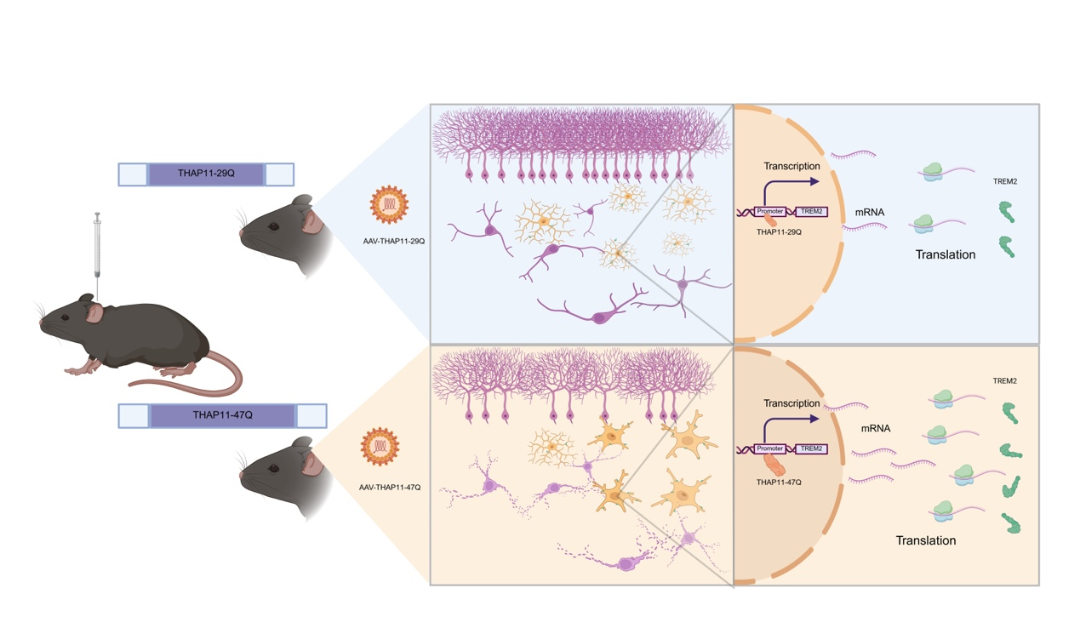
图7.文章总结图
文章结论与讨论,启发与展望
综上所述,本研究通过构建SCA51转基因动物模型,深入探讨了突变THAP11引发神经退行性变的分子机制。研究发现,成年脑内THAP11基因敲低并未引起显著的神经元丢失,这一关键结果为开发基于THAP11表达调控的靶向治疗策略提供了理论依据。更为重要的是,突变THAP11-47Q在小鼠脑内诱发典型的蛋白聚集以及小脑特异性的神经退行性病变,使SCA51成为研究神经退行性疾病中选择性易感机制的理想模型。本研究还首次揭示了TREM2介导的小胶质细胞活化在polyQ疾病中具有特异性,其激活模式和致病效应呈现明显的疾病背景依赖性。这一创新性发现不仅拓展了对神经退行性疾病免疫调控机制的理解,也为相关疾病的免疫干预治疗提供了新的思路和潜在靶点。
原文链接:https://www.jci.org/articles/view/178349
转载须知:未经授权禁止转载,违者必究。