
服务热线

2025年10月14日,中国药科大学郝海平、谢昊团队在Cell Metabolism期刊发表题为:“Galnt2 neurons in the ventromedial hypothalamus counterregulate hypoglycemia via a brain-liver neurocircuit”的文章。本研究揭示了一条由下丘脑腹内侧核Galnt2阳性神经元发起,经由脑-肝神经回路直接感知并对抗神经低血糖的全新机制。该发现不仅提出了血糖反调节的双相模型,还为理解大脑在能量危机中的“终极防御”策略提供了新框架,为代谢性疾病的治疗开辟了新途径。
该项研究工作采用铭泰佳信自主研发的前沿创新仪器:活体脑化学物质实时分析系统,实现了对自由活动小鼠下丘脑腹内侧核区域的细胞外葡萄糖浓度的在体原位实时动态监测。该技术提供的高时间分辨率的在体脑糖数据,使其充当了“大脑血糖监测仪”的角色,与传统的机体血糖监测共同阐明脑-组织血糖调控规律,是连接全身血糖变化与中枢神经元活动的桥梁,为研究者提出“阈值依赖性脑糖感知”和“双相反调节模型”这一核心创新理论提供了直接实验依据,使整个研究逻辑链条更加完整。
研究亮点:
1、双相模型解释了低血糖的代偿反应。
2、VMH葡萄糖抑制神经元在神经低血糖感知方面功能至关重要。
3、脑-肝神经回路突显了低血糖的代偿反应。
4、Galnt2 作为 VMH 葡萄糖抑制神经元的遗传标记和分子刹车。
技术手段:
活体脑化学检测技术 | 病毒追踪 | 化学/光遗传操控 | 在体钙成像 | 单细胞核RNA测序 | 行为学→ 精准解析脑肝对话的完整回路
研究背景:
本研究立足于一个长期存在的科学谜团:尽管激素被认为是机体对抗低血糖的主要手段,但大量证据表明存在未知的快速补偿机制。大脑作为最依赖葡萄糖的器官,其下丘脑中被发现存在特殊的葡萄糖抑制性(GI)神经元,然而这些神经元在真实生理状态下究竟是直接感知脑内糖匮乏,还是仅整合外周信号,数十年来一直存在争议。同时,肝脏接受交感神经支配并影响糖代谢的现象虽被观察,但连接大脑感知与肝脏执行的具体神经通路始终未被完整描绘。因此,本研究旨在揭示大脑是否以及如何通过一条特定的“脑-肝神经回路”,直接感知危险的神经低血糖并启动快速的血糖救援,以弥补传统激素机制的不足。
文献解读:
脑-肝通路的发现与功能奠基
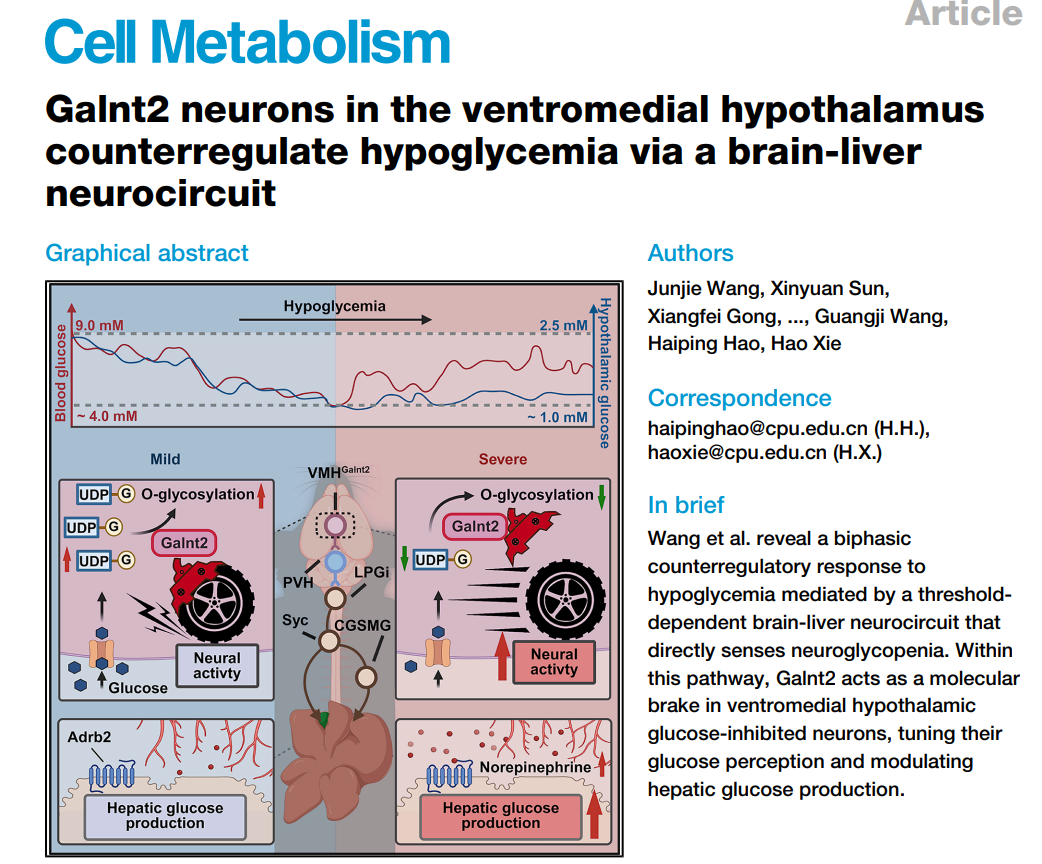
文章采用创新性的脑糖,血糖实时原位监测技术,研究人员发现自由活动小鼠进行36小时禁食期间的血液与下丘脑葡萄糖呈现独特的双相下降模式,在后期阶段,下丘脑葡萄糖稳定在约1.0 mM阈值附近,而血糖则呈现波动性回升。通过选择性肝交感神经切除术证实:去除神经支配后,这种稳定的双相模式被完全破坏,脑糖,血糖均呈现持续性下降。说明肝交感神经在此过程中的关键作用。为验证肝交感神经在此过程中的关键作用,研究通过选择性肝交感神经切除术证实:去除神经支配后,这种稳定的双相模式被完全破坏,血糖呈现持续性下降。进一步的高胰岛素-低血糖钳夹实验显示,肝去神经小鼠需要显著提高外源葡萄糖输注率才能维持目标低血糖水平,表明其内源性葡萄糖生成能力严重受损。
机制探索方面,实时化学监测显示低血糖可触发肝内去甲肾上腺素的爆发式释放。通过全组织透明化成像技术,研究在小鼠和人类肝脏中均证实了沿血管系统分布的密集交感神经网络。最后,采用跨突触病毒逆向追踪方法,研究者完整绘制出从肝脏出发,经交感神经节、延髓,最终抵达下丘脑的完整神经通路,为脑-肝轴的存在提供了坚实的解剖学证据。
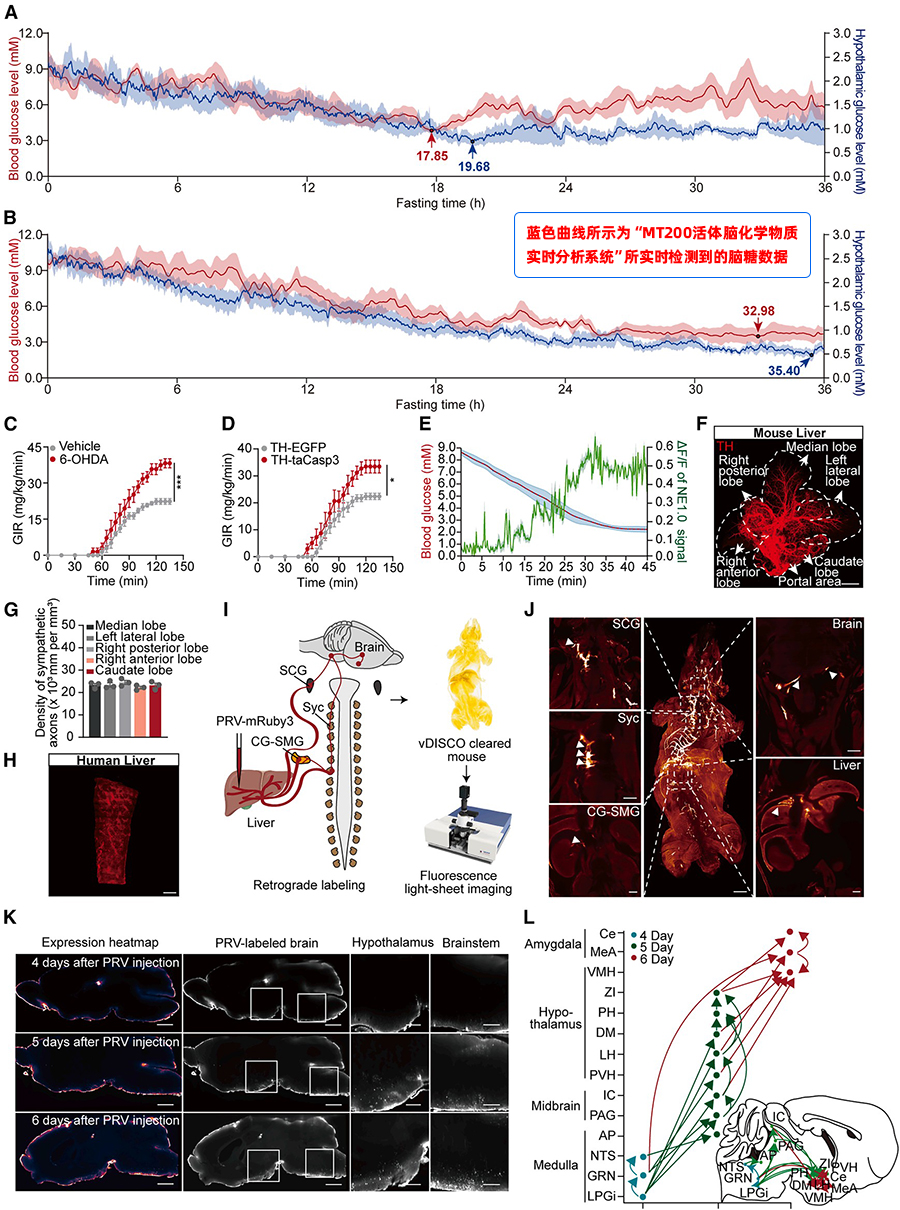
图1 脑-肝通路是持续葡萄糖监测中双相模式的基础
VMH、PVH和LPGi三个关键节点的筛选
根据Figure 1提供的“蓝图”,在全脑范围内筛查,找到具体是下丘脑的哪些核团(VMH, PVH, LPGi) 在低血糖时被激活并与肝脏连接。
通过整合c-Fos染色与病毒逆向追踪技术,对低血糖状态下被激活的脑区进行系统性筛选。在初步鉴定的77个活跃脑区中,研究成功聚焦于VMH、PVH和LPGi三个关键节点,这些区域不仅在高血糖状态下显著激活,且与肝脏存在明确的神经连接,因而被确定为构成“脑-肝”升糖回路的核心候选脑区。
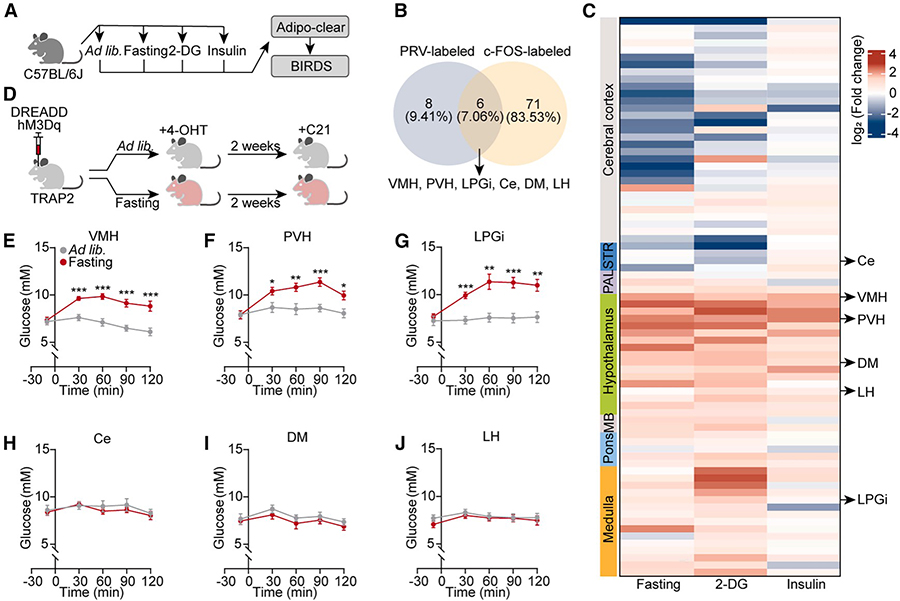
图2 激活 VMH、PVH 和 LPGi 中被 TRAP 技术捕获的神经元可以提高血糖水平
LPGi GABA能神经元通过交感神经驱动肝葡萄糖生成
深入探究Figure 1中通路的最终执行节点(LPGi GABA能神经元) 是如何具体指令肝脏工作的。
研究首先通过单细胞核RNA测序,鉴定出LPGi中与肝脏存在特异性连接的神经元亚型为GABA能抑制性神经元,明确了该群体的细胞属性。
在此基础上,研究通过在体特异性调控该神经元亚群的功能,发现激活LPGi GABA能神经元可高效引发肝内去甲肾上腺素释放,显著提升肝葡萄糖生成及血糖水平,证实其在生理层面的关键作用。
机制研究表明,该过程主要通过交感神经-β2肾上腺素能受体轴激活肝内糖原分解途径实现。值得注意的是,此效应完全依赖于肝交感神经的结构完整性与功能活性,而不依赖于循环激素系统的参与。
综上,Figure 3系统揭示了LPGi GABA能神经元作为“脑-肝”通路最终执行节点的作用机制,明确了其通过特异性神经通路直接调控肝脏葡萄糖代谢的独特功能。
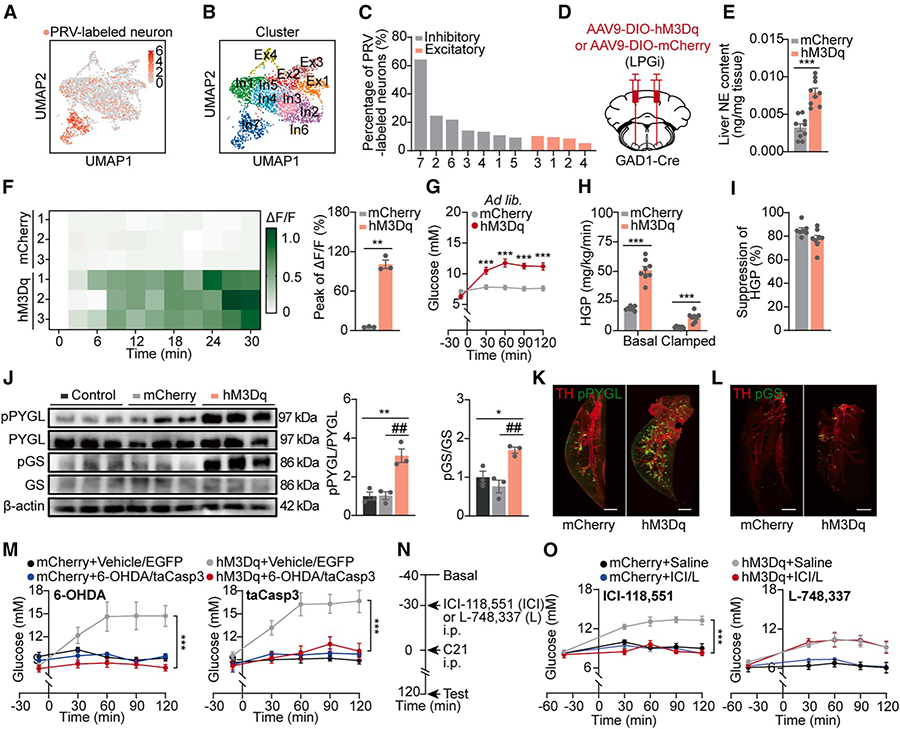
图3 LPGi 中的 GABA 能神经元通过激活肝内交感神经促进肝脏葡萄糖生成 HGP
界定核心回路:VMH→PVH→LPGi层级通路
旨在验证Figure 1中描绘的从高级中枢(VMH)到执行节点(LPGi)的具体连接路径(VMH→PVH→LPGi) 是否真实且如何形成完整的“脑-肝”升糖神经回路。
研究首先通过光遗传学方法验证了VMH→PVH通路的功能必要性:激活该通路可显著升高血糖,而抑制VMH或PVH神经元则会损害机体的低血糖反调节能力,证明这两个节点在升糖回路中不可或缺。
为进一步确认信号传递路径,研究者采用化学遗传学交互干预实验:在抑制PVH神经元活动的同时激活VMH神经元。结果显示,当PVH被抑制时,VMH的激活无法再引起血糖升高,证明VMH的升糖信号必须通过PVH中继传递,PVH是本回路的关键枢纽。
通过三重逆向病毒追踪技术,研究发现76%的禁食激活VMH神经元同时接收来自PVH和LPGi的输入,从解剖学上证实了VMH→PVH→LPGi这一连接路径的存在。
最后,研究验证了回路末端的功能连接:激活PVH→LPGi投射可升高血糖,而抑制LPGi区的GABA能神经元则显著削弱此效应,证明PVH通过激活LPGi的GABA能神经元来传递升糖信号。
至此,一条完整的“脑-肝”升糖核心回路得以明确:VMH → PVH → LPGi → GABA能神经元 → 肝脏。
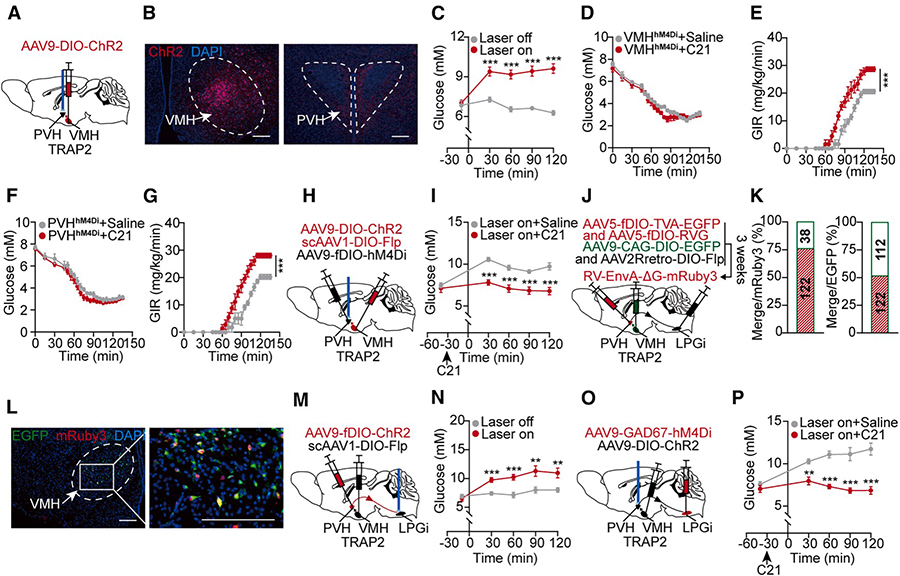
图4 VMH→PVH→LPGi 神经回路通过激活 LPGi 中的 GABA 能神经元来提高血糖水平
VMH神经元直接感知脑内低血糖
旨在探究Figure 1中作为回路起点的高级中枢(VMH)如何获得“血糖危机”的信号(直接感知神经低血糖)。
研究结合离体与在体实验,系统评估了VMH神经元对低糖的响应特性。在离体脑片实验中,钙成像显示84.8%的VMHTRAPed神经元在低糖条件下钙信号频率与幅度显著增强;电生理记录进一步表明80%的神经元表现出放电频率增加与静息膜电位去极化。这些结果共同证实了该群体具有葡萄糖抑制性神经元的典型特征,并具备内在的糖感知能力。
在体实验中,双光子显微镜观察发现禁食小鼠的VMHTRAPed神经元基础钙活动水平显著升高。进一步通过同步多通道记录技术,在胰岛素诱导的低血糖过程中实时监测神经元钙信号、下丘脑葡萄糖浓度与血糖水平,发现当血糖降至约4.0 mM、下丘脑葡萄糖降至约1.0 mM时,VMH神经元钙信号出现爆发式增长,明确了其体内激活阈值,并与离体结果高度一致。
为解析其下游效应机制,研究通过在VMH局部注射2-DG诱导神经低糖,发现可迅速引发神经元激活及肝内去甲肾上腺素释放,而血浆中胰高血糖素、皮质酮等反调节激素水平未见显著变化。这表明VMH GI神经元触发的升糖反应主要依赖“脑-肝”交感神经通路,而非传统激素系统。
综上所述,图5完成了从“感知”(VMH GI神经元)到“整合”(VMH→PVH→LPGi回路)再到“执行”(LPGi→肝脏交感神经)的完整逻辑闭环,确立了大脑作为直接葡萄糖传感器在血糖稳态中的核心地位,并揭示了神经通路在低血糖应急响应中的优先机制。
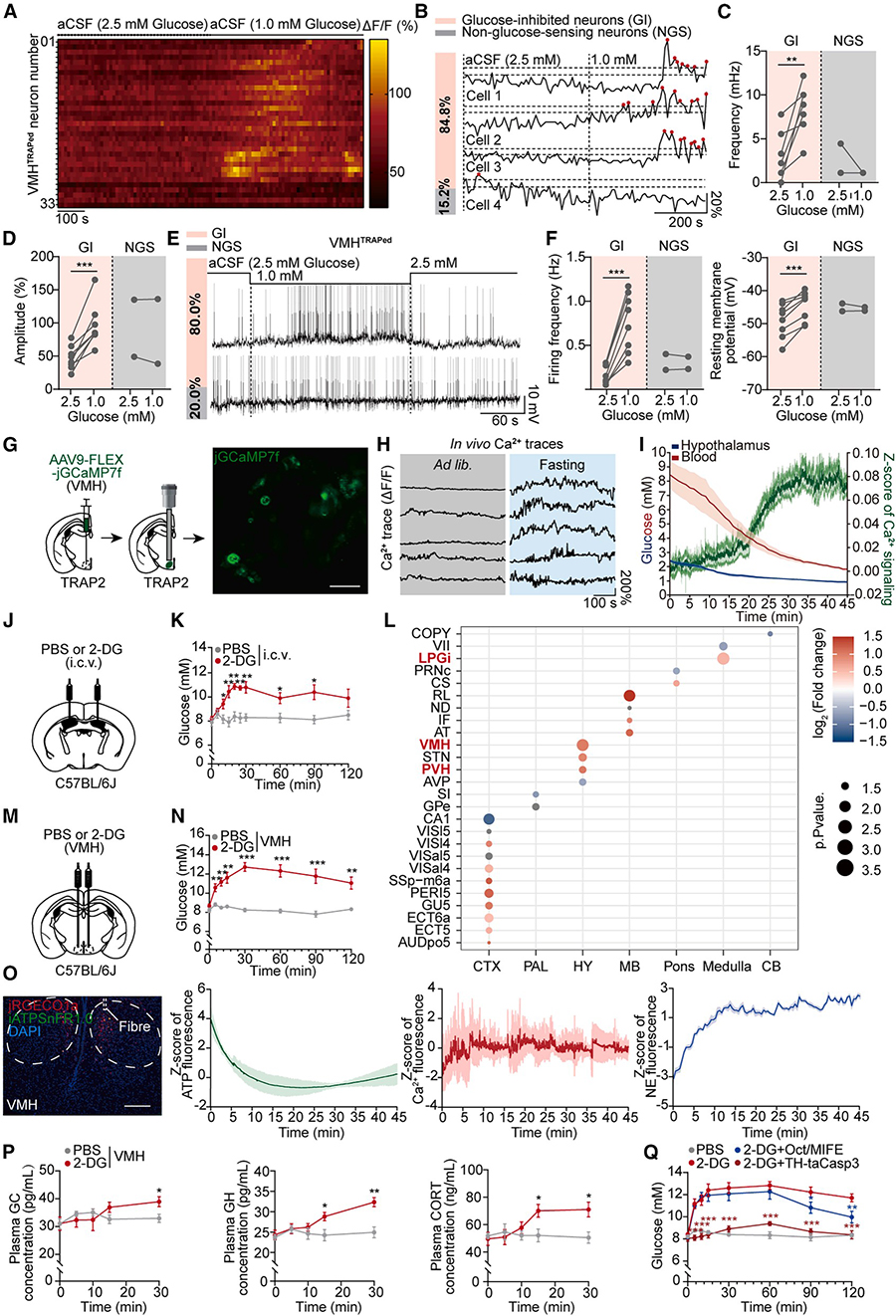
图5 VMHTRAPed 神经元是 GI 神经元,在神经低血糖期间激活脑-肝神经回路
发现关键分子标记:Gaint2
旨在最终从分子层面精准鉴定VMH中感知低血糖的关键神经元群体,并识别调控其兴奋性阈值的特异性分子“刹车”——Galnt2。
研究采用TRAP2技术在活体内特异性标记并捕获低血糖状态下激活的VMH神经元,通过流式细胞术分选其细胞核后进行单细胞核RNA测序。对约13,000个细胞核的分析显示,其中58%为神经元,进一步可划分为18个亚簇。通过功能富集分析,最终确定其中5个簇(B1、B2、B11、B5、B17)在TRAPed群体中显著富集,代表在禁食低血糖状态下被特异性激活的VMH神经元亚群。
基因表达差异分析显示,Galnt2基因以最高表达差异倍数(2.46倍)在激活神经元中特异性高表达,显著高于其他候选基因(如Marchf1和Pisd),因而被确立为VMH低血糖响应神经元的顶级分子标志物。后续功能验证实验中,特异性激活VMH Galnt2神经元可引发显著血糖升高,进一步确认了该群体在血糖调控中的关键作用。
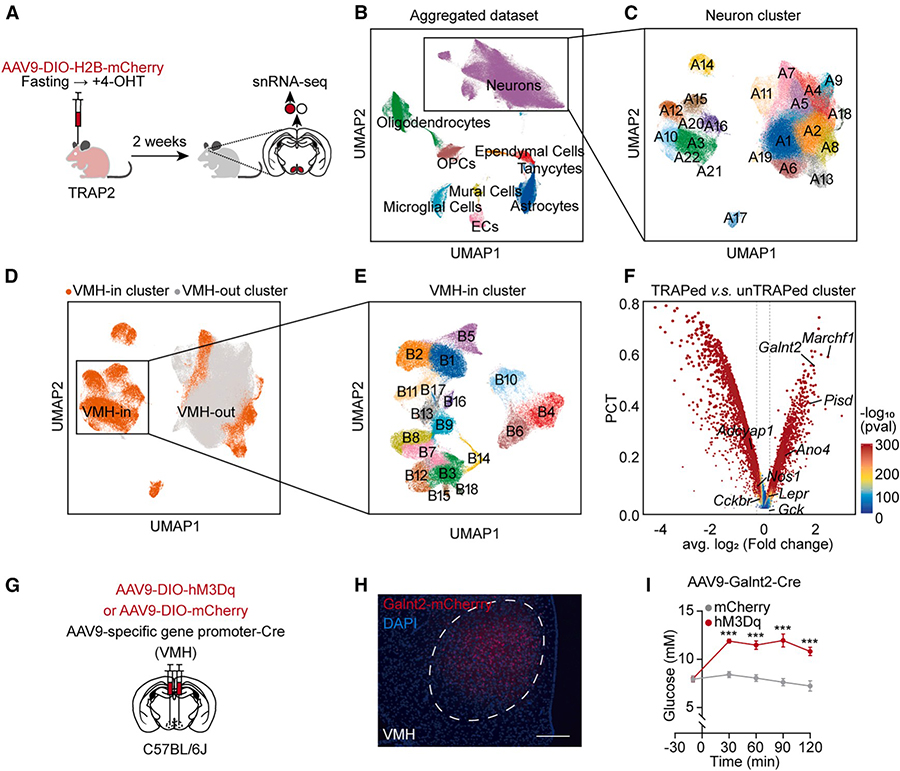
图6 VMHGalnt2 神经元的转录组分析和功能激活
机制深度剖析——Gaint2作为“分子刹车”的功能
旨在揭示Galnt2基因在VMH葡萄糖感应神经元中的具体功能,明确其究竟是一个被动的“标记”,还是参与调控神经元活动的主动“调控者”。
在离体脑片实验中,当环境葡萄糖浓度从5.0 mM逐步降至1.0 mM时,Galnt2敲低的神经元在较高葡萄糖浓度(如2.5 mM)下即表现出钙信号强度和放电频率的显著增强,而对照组神经元仅在葡萄糖浓度降至1.0 mM阈值时才被强烈激活。进一步定量分析显示,Galnt2敲低神经元的电流阈值(即诱发动作电位所需的最小电流)显著低于对照组,表明Galnt2在维持VMH神经元正常兴奋性阈值中发挥关键作用。这些结果说明,敲低Galnt2相当于“松开”了神经元的分子刹车,使其在生理血糖水平下也趋于异常激活,易于发生“误报警”。
为验证Galnt2的酶活性在调控神经元活动中的直接作用,研究进一步采用药理学方法,证实其O-GalNAc糖基化活性可动态调节神经元对葡萄糖的响应强度。在体实验结果显示,Galnt2敲低可增强机体对低血糖的反调节能力,表现为更有效的血糖恢复;然而长期敲低则导致代谢稳态失衡,引发肥胖与血糖紊乱。
综合以上发现,Galnt2作为“分子刹车”在维持代谢平衡中具有重要生理意义。在正常状态下,它抑制升糖回路的过度激活,避免能量浪费与代谢紊乱;而一旦该调控机制失灵,将引起神经元持续异常放电,推动肝糖过量输出、高血糖及肥胖等代谢异常的发生。因此,Galnt2是中枢调控长期代谢稳态的一个关键分子。
至此,该研究完整实现了从“现象发现”到“环路解析”再到“机制阐明”的系统科学探索,构建出由Galnt2介导的、基于阈值调控的“脑感知–肝输出”葡萄糖稳态新模型,为深入理解大脑在代谢调控中的核心作用提供了全新的理论框架与潜在靶点。
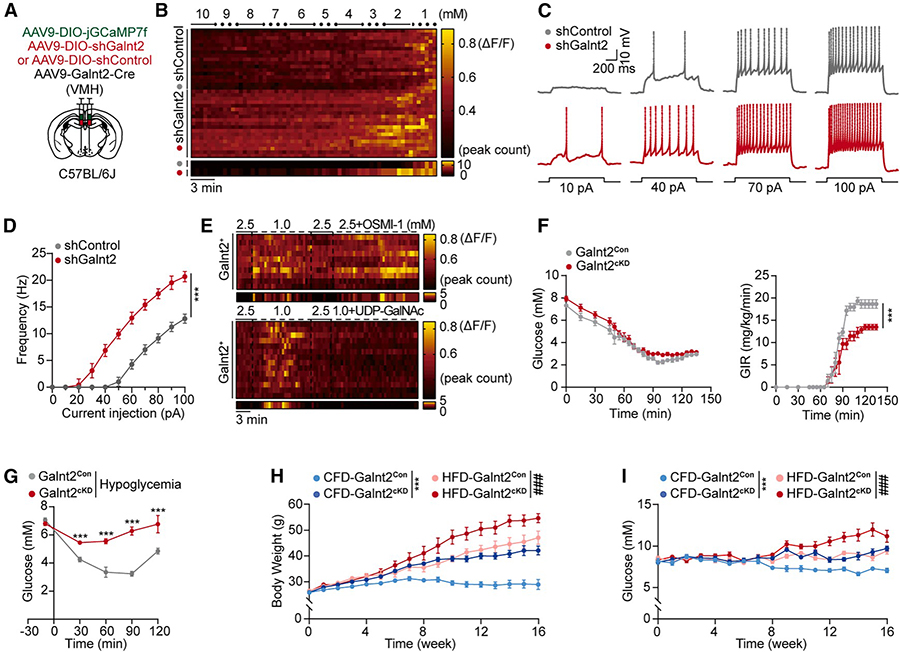
图7 Galnt2 调节低血糖感知的血糖阈值和代谢稳态
结 论
本研究发现并阐明了一条由下丘脑Galnt2阳性葡萄糖抑制性神经元介导、经VMH→PVH→LPGi→肝脏交感神经通路的全新“脑-肝”神经回路。该通路能够直接感知脑内葡萄糖水平下降,在血糖降至约4.0 mM(对应下丘脑葡萄糖约1.0 mM)的生理阈值时被激活,并通过增强肝内去甲肾上腺素释放及β2-肾上腺素能受体信号,快速驱动肝葡萄糖生成。研究进一步揭示Galnt2作为该通路的“分子刹车”,通过O-GalNAc糖基化修饰精细调控神经元的兴奋性阈值,防止其在正常生理状态下过度激活。
这项工作不仅首次完整描绘了大脑直接感知血糖危机并通过特异性神经通路指令肝脏产糖的完整机制,建立了“阈值依赖型双相血糖反调节”新模型,更革新了长期以来主要依赖激素调控血糖的传统认知。该发现为理解低血糖感知异常、糖尿病血糖波动等临床问题提供了全新理论框架,也为开发针对中枢神经通路的新型代谢疾病治疗策略奠定了重要基础。