
服务热线

近十余年来,神经-免疫互作(neuroimmune interaction)逐渐被认为是调控脑功能和行为状态的重要机制之一。免疫系统不仅通过外周炎症反应影响身体健康,还能通过细胞因子(cytokines)、趋化因子(chemokines)等信号分子作用于中枢神经系统。在成瘾领域,越来越多证据表明,药物滥用会激活外周及中枢的免疫反应,改变小胶质细胞和星形胶质细胞的活化状态,释放多种炎症因子,从而重塑奖赏环路的功能。然而,目前研究主要关注胶质细胞介导的间接作用,对于炎症因子对神经元的直接调控作用及其在成瘾行为中的角色仍知之甚少。此外,既往研究发现,吸烟人群在感染等急性疾病期间往往会减少吸烟量,但背后的神经机制不明。由于尼古丁成瘾的核心机制依赖中脑腹侧被盖区(VTA)多巴胺神经元的兴奋,免疫因子是否能通过直接调节此类神经元活性来影响成瘾行为尚未清楚。
Molecular Psychiatry杂志发表的“Interleukin 13 signaling modulates dopaminergic functions and nicotine reward in rodents”中,首次揭示了免疫炎症因子白细胞介素-13(IL-13)及其受体对中脑多巴胺神经元活动的直接调控作用,并鉴定PI3K/AKT-HCN离子通道为其关键下游信号通路。研究发现,IL-13能抑制尼古丁对多巴胺神经元的兴奋效应,并显著降低尼古丁自给药行为。

首先,研究利用中脑多巴胺神经元的单细胞核测序,系统分析了该类神经元中主要免疫炎症因子受体的表达谱,发现IL-13Rα1和IL-4R的表达量最高。进一步通过IL-13Rα1与TH的免疫染色,并结合Allen Brain Atlas的原位杂交数据,确认在全脑范围内,IL-13Rα1仅特异性表达于中脑多巴胺神经元。
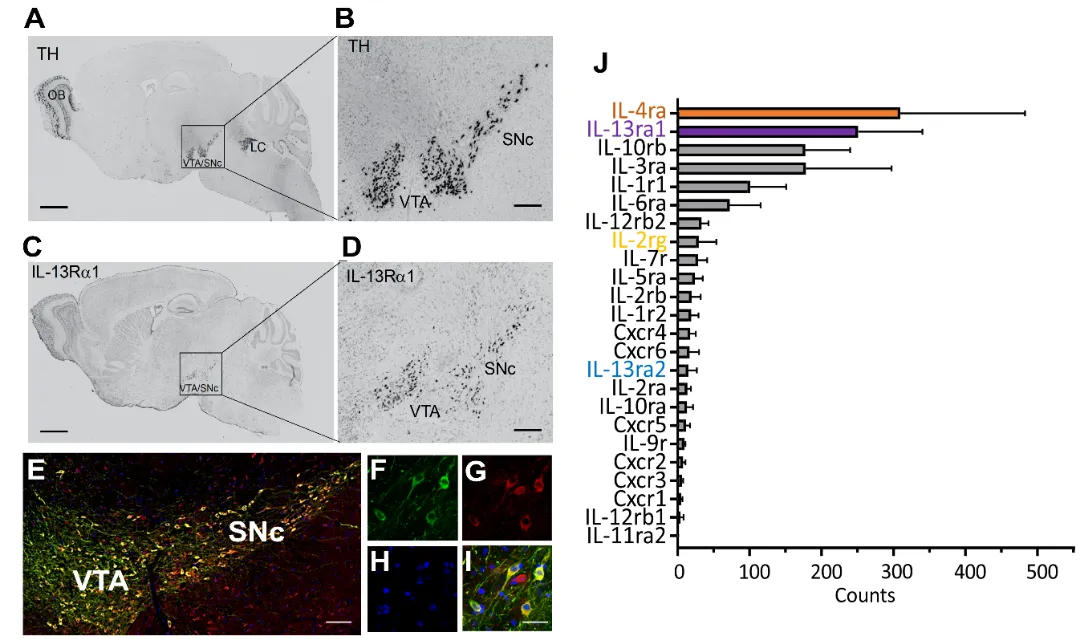
图1 IL-13Rα1受体只特异性地在多巴胺神经元中表达,并且是该类神经元中表达量最高的免疫受体之一
随后,研究分析了腹侧被盖区(VTA)内源性IL-13的分布,意外发现IL-13存在于神经元突触前膜,尤其富集于接近活性区的突触囊泡中。急性脑片结合IL-13-Cre::Ai32转基因小鼠的特异性光遗传激活实验表明,激活VTA区IL-13阳性神经纤维可显著抑制多巴胺神经元的放电活动。外源性灌流IL-13同样产生抑制作用,且该效应依赖IL-13Rα1受体。
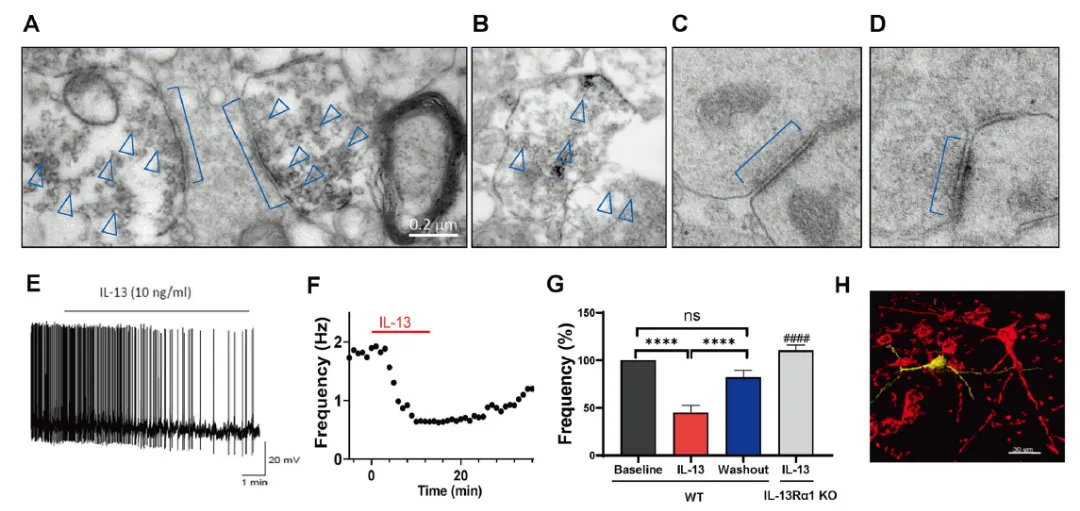
图2 内源性IL-13可存在于神经元突触前膜囊泡中,内源性激活IL-13神经末梢或者外源性灌流IL-13均可显著抑制多巴胺神经元活动
鉴于VTA多巴胺神经元在成瘾行为中的核心作用,研究进一步探讨了IL-13及其受体对尼古丁成瘾行为的影响。通过DAT-Cre::AI38小鼠首先证实IL-13可抑制多巴胺神经元的钙信号活动;尼古丁可显著增强该钙活动,但这一效应可被IL-13阻断。进一步验证,IL-13能抑制尼古丁对多巴胺神经元兴奋性的促进作用。行为学与药理学实验显示,向VTA局部灌注IL-13可显著减少大鼠对尼古丁的静脉自给药行为,而对自主取食行为无显著影响;相反,IL-13Rα1基因敲除则导致小鼠显著增加尼古丁的自我摄取量。这些结果表明,IL-13系统可特异性干预尼古丁成瘾行为。
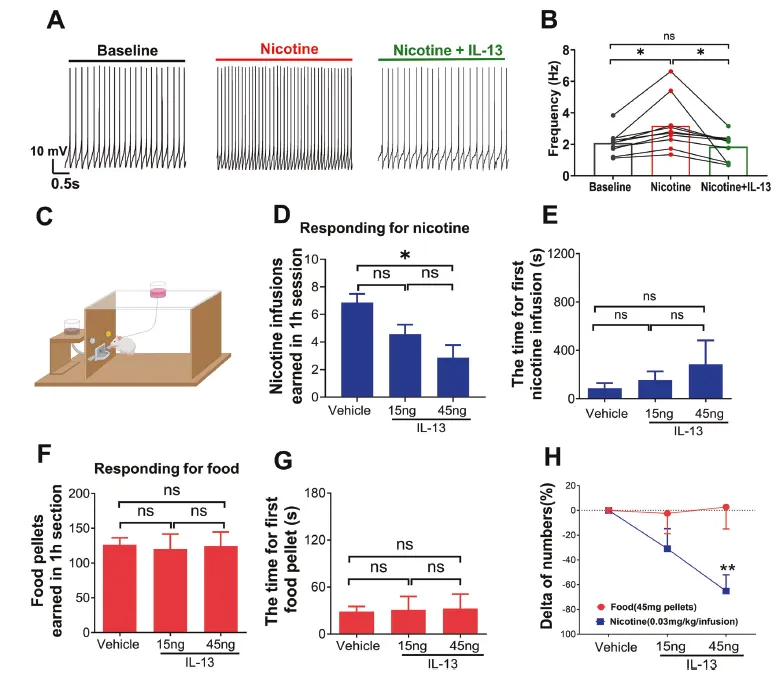
图3 IL-13可显著削弱尼古丁对多巴胺神经元的兴奋作用,并显著干预大鼠尼古丁静脉自给药行为
研究进一步阐明了IL-13/IL-13Rα受体作用的下游机制。IL-13通过抑制HCN通道(超极化激活环核苷酸门控阳离子通道)降低多巴胺神经元的兴奋性。作为一种常见的外周II型免疫因子受体,IL-13Rα通常经JAK/STAT激酶通路发挥作用,尤其在过敏性气道反应中具有重要作用。然而,本研究发现IL-13并未显著改变VTA组织中JAK/STAT的水平,而是显著上调了PI3K/AKT的磷酸化水平。进一步地,特异性激酶抑制剂阻断了IL-13对多巴胺神经元活动及尼古丁成瘾行为的调控作用。这些结果表明,IL-13/IL-13Rα受体主要通过PI3K/AKT–HCN通道信号轴实现对多巴胺神经元及成瘾行为的调控。
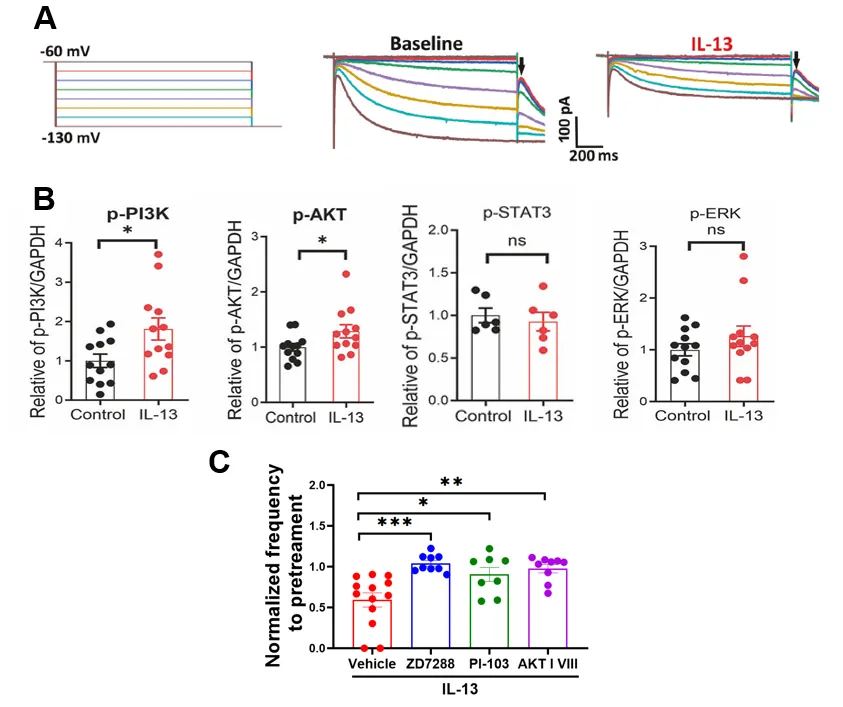
图4 IL-13对多巴胺神经元活动及功能的抑制作用依赖于AKT/PI3K和HCN通道
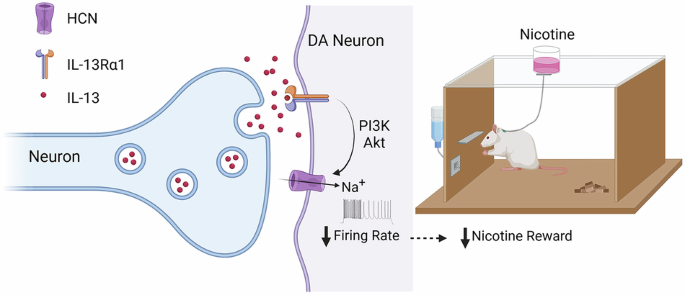
图5 IL-13可作为一种囊泡释放的“神经调质”,通过突触后IL-13Ra1受体及相关信号通路,对多巴胺神经元及尼古丁成瘾行为起到显著的调控作用
结论与讨论
本研究首次将传统意义上的免疫因子IL-13重新定义为一种“神经调质”,并揭示其对多巴胺系统的直接调控作用。研究表明,IL-13通过激活PI3K/AKT–HCN通道信号,抑制VTA多巴胺神经元兴奋性,从而削弱尼古丁的奖赏效应。这不仅突破了以往聚焦于病理状态下IL-13功能的局限,也为理解免疫信号在正常大脑中的作用提供了新证据。这一发现标志着IL-13从“炎症因子”到“神经调节分子”的范式转变,具有重要的创新性与启示意义。
该研究的另一大亮点在于从分子到行为建立了完整的证据链。尤其是通过光遗传诱导内源性IL-13释放,强化了其生理相关性。基于此,该研究提出了“神经免疫调节成瘾”的新机制,提示在感染或应激等状态下,IL-13的升高可能通过抑制多巴胺系统导致动机下降,进而影响成瘾行为。
对神经免疫学领域而言,其发现IL-13定位于突触前囊泡,暗示其可能类似神经肽被释放并参与突触传递,为理解细胞因子在神经系统的非经典功能提供了重要线索。同时,IL-13Rα1在多巴胺神经元中的关键作用使其成为潜在的成瘾干预靶点;结合人群中与吸烟行为相关的基因多态性,更凸显其临床转化价值。此外,IL-13Rα1位于X染色体并可能与雌激素信号交互,也为未来探索性别差异和个体化治疗提供了方向。
总之,本研究不仅在机制层面揭示了IL-13作为新型神经调质的功能,更在行为学层面证实了其对尼古丁奖赏的抑制作用。这一工作为神经免疫与成瘾研究的融合开辟了新路径,也为未来探索免疫信号在动机和情绪调控中的作用提供了坚实基础。
原文链接:doi.org/10.1038/s41380-025-03137-3
实验延展
在此项实验研究中,多巴胺的检测具有核心价值,不仅是验证IL-13直接调控多巴胺神经元的关键实验环节,更是连接分子机制、神经环路、行为表型与转化意义的核心枢纽。它使得研究从“IL-13抑制神经元放电”推进到“IL-13抑制多巴胺释放并降低尼古丁奖赏”,从而在神经免疫学与成瘾科学交叉领域建立起一条清晰、完整、具有生理与病理相关性的科学逻辑链条。

若能实时、动态检测多巴胺浓度变化,将为验证“连接IL-13信号通路调控与尼古丁成瘾行为改变之间因果链条”提供更直接证据,更是将研究从静态的、相关性描述提升至动态的、机制性阐释的技术支撑。北京铭泰佳信科技有限公司自主研发的活体脑化学物质实时分析系统,能够在清醒自由活动的动物中连续实时捕捉多巴胺等物质的动态变化,毫秒级分辨率,可为研究提供全新的技术支持。
1.实现对多巴胺动态释放的毫秒级分辨率检测
实时动态捕捉多巴胺的瞬态释放变化,可直观验证IL-13是否直接抑制尼古丁诱导的多巴胺释放,而非仅影响神经元放电频率,从而更直接地建立“IL-13→多巴胺释放减少→奖赏行为减弱”的因果链。
2.支持在自由活动动物中进行自然行为关联分析
系统可在自由活动动物中同步记录多巴胺释放与行为事件,实现神经化学与行为学的实时关联。在尼古丁自我给药实验中,可实时观察每次给药前后多巴胺释放的动态变化,直接验证IL-13是否降低尼古丁诱发的多巴胺释放峰值,从而解释其减少成瘾行为的神经化学基础。
3.提供神经递质释放的特定脑区信号
系统可在特定脑区进行空间定位监测,结合特异性电极或双通道检测,揭示多巴胺释放在不同脑区或环路中的异质性。有助于明确IL-13是否特异性影响尼古丁诱导的多巴胺释放。
4.促进对IL-13作为“神经调质”功能的深入理解
实时检测可在生理或行为激活状态下揭示其快速神经调节作用。若IL-13在尼古丁暴露后迅速抑制多巴胺释放,可支持其作为快速神经调质的功能,而非仅作为慢速炎症信号分子。

使用活体脑化学物质实时分析系统可在时间分辨率、特定脑区、行为关联、通路验证等方面增强本研究的深度,弥补电生理与钙成像在直接监测神经递质动态方面的不足,为“神经免疫调节成瘾”机制提供更完整的证据链。