
服务热线

韩国科学技术院Greg S.B. Suh实验室Jineun Kim等研究人员在Neuron期刊发表题为:“Encoding the glucose identity by discrete hypothalamic neurons via the gut-brain axis”的文章。本文研究揭示了肠道D-葡萄糖通过下丘脑特定神经元(CRFPVN)和脑肠轴进行编码,并抑制空腹状态下CRFPVN神经元的活性。该研究发现为理解动物在空腹状态下对糖的需求提供了新的见解,并为糖尿病和相关疾病的治疗提供了理论依据。

技术亮点:
光纤记录|双光子成像|病毒追踪|光遗传操控→解锁神经环路的动态密码
文章的研究背景是探索动物在空腹状态下对糖,特别是D-葡萄糖的需求,以及肠道如何检测和响应D-葡萄糖。这一研究背景涉及葡萄糖作为主要能量来源的重要性、肠道宏量营养素检测的神经机制、下丘脑室旁核(PVN)中CRF神经元的作用,以及肠脑轴在能量代谢调节中的作用。文章旨在通过探索肠道D-葡萄糖感知的神经机制,以及这种感知如何通过肠脑轴影响动物的行为和能量代谢,来填补这些知识空白。
研究方法和研究结果
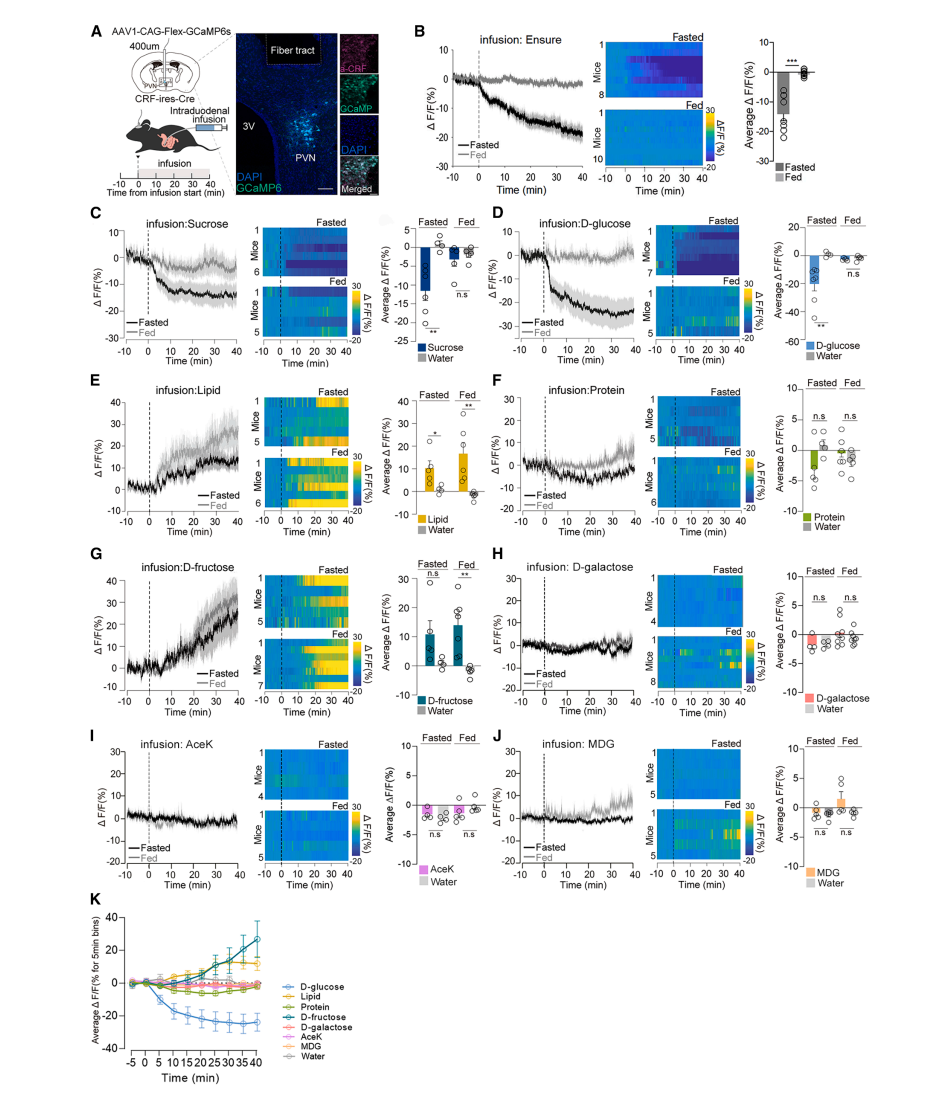
图1 CRFPVN神经元对含D-葡萄糖的糖类有特异性反应
过程:通过光纤光度法记录自由活动小鼠CRFPVN神经元的GCaMP6s信号,同时向十二指肠输注不同营养物质。
结果:D-葡萄糖特异性抑制:肠道输注D-葡萄糖(30%)显著抑制CRFPVN神经元活动(ΔF/F下降),且禁食小鼠的抑制效应更强(图1D,1K)。
其他营养物质的对比:
脂质(13.3%intralipid):激活神经元(ΔF/F上升)(图1E,1K);
蛋白质(30%):无显著影响(图1F,1K);
其他糖类:
D-果糖(30%)激活神经元(图1G);
D-半乳糖(30%)无影响(图1H);
非营养甜味剂(蔗糖素、AceK、MDG)无作用(图1I-J)。
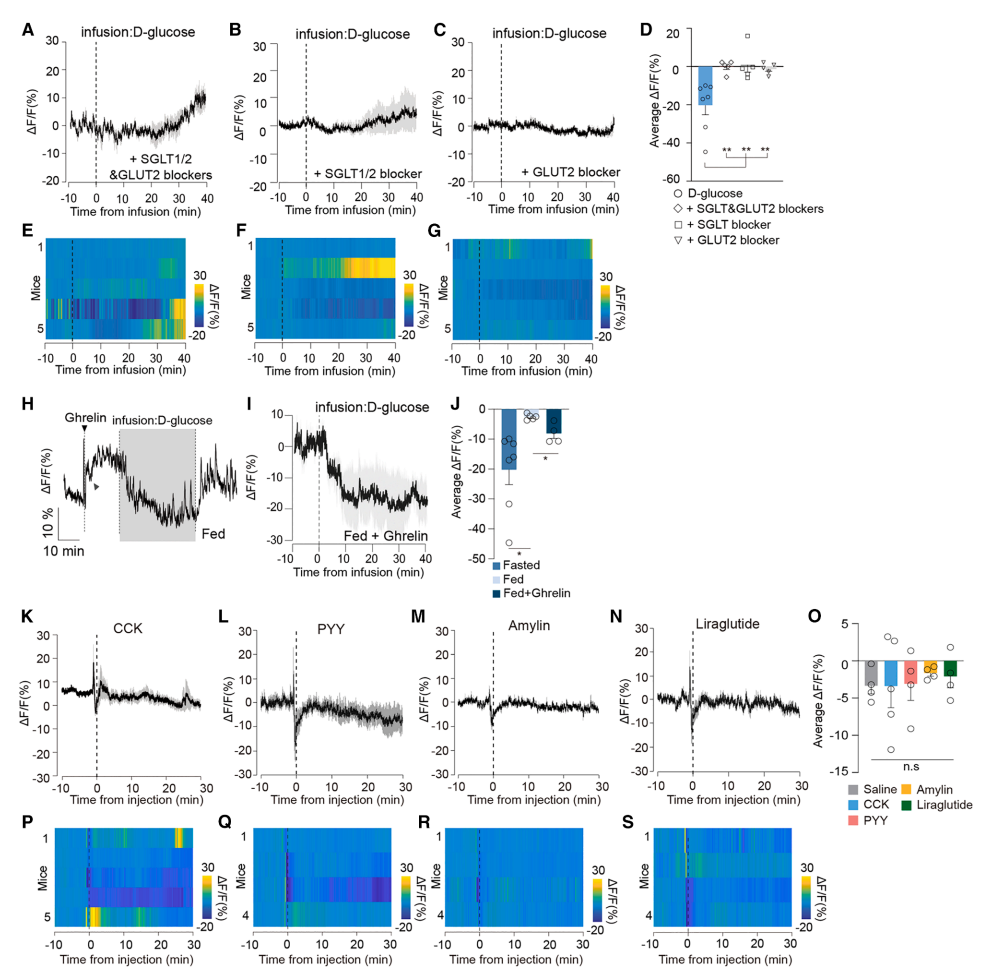
图2 D-葡萄糖抑制CRFPVN的机制依赖转运蛋白,而非激素
结果:
共输注葡萄糖转运抑制剂(phlorizin阻断SGLT1/2,phloretin阻断GLUT2)完全阻断D-葡萄糖的抑制效应(图2A-G),表明响应依赖肠道吸收后的信号。
胃肠激素的影响:
饥饿激素激活神经元,而后续D-葡萄糖输注可逆转此效应(图2H-J)。饱腹激素(CCK、PYY、胰淀素、利拉鲁肽)对神经元活动无显著影响(图2K-S),排除体液信号主导。
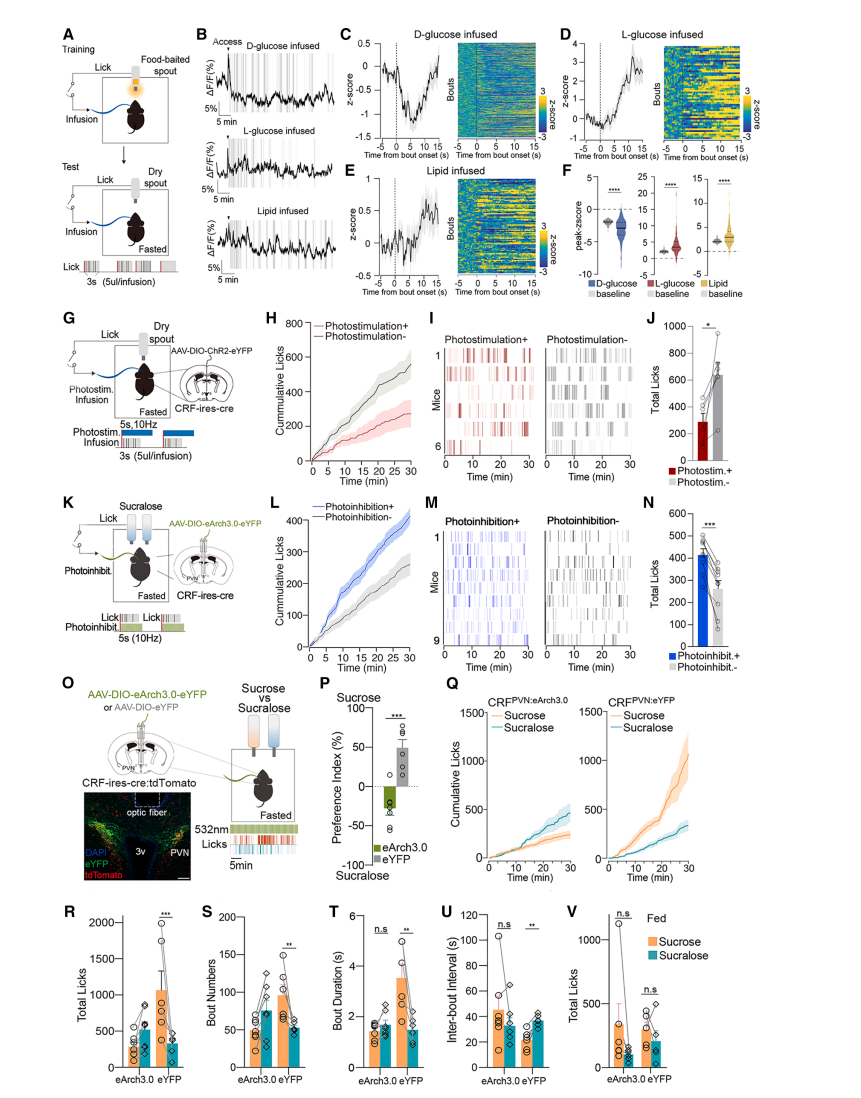
图3 CRFPVN神经元的活动对于D-葡萄糖在操作性自我输注中的正向强化作用
结果:CRFPVN神经元调控葡萄糖摄取的实时行为
操作性条件反射实验(图3A):
禁食小鼠通过舔舐干喷口触发肠道输注(D-葡萄糖/L-葡萄糖/脂质)。
神经元活动与行为关联:
触发D-葡萄糖输注时,CRFPVN活动被抑制(图3B-C,3F);
触发L-葡萄糖或脂质输注时,神经元被激活(图3D-F)。
光遗传学干预:
人工激活CRFPVN神经元(舔舐触发蓝光)显著减少D-葡萄糖摄入(图3G-J);
抑制神经元(舔舐触发绿光)增加蔗糖素偏好(图3K-N)。
双瓶选择实验:
光遗传抑制CRFPVN神经元消除禁食小鼠对蔗糖(vs.蔗糖素)的偏好(图3P-U),但不影响饱食小鼠摄食(图3V)。

图4 单细胞钙成像揭示营养特异性神经元亚群
过程:通过GRIN透镜双光子成像,记录头固定小鼠单个CRFPVN神经元的钙信号。
结果:
D-葡萄糖:54%神经元被抑制(图4B-E);
L-葡萄糖/脂质:分别有29%/49%神经元被激活(图4E,4N);
双向响应亚群:35%D-葡萄糖抑制神经元被L-葡萄糖激活(图4F-G);56%被脂质激活(图4O-P);
解码能力:双向响应神经元可高精度区分D-葡萄糖与其他营养物质(SVM解码,图4H-I,4Q-R)。
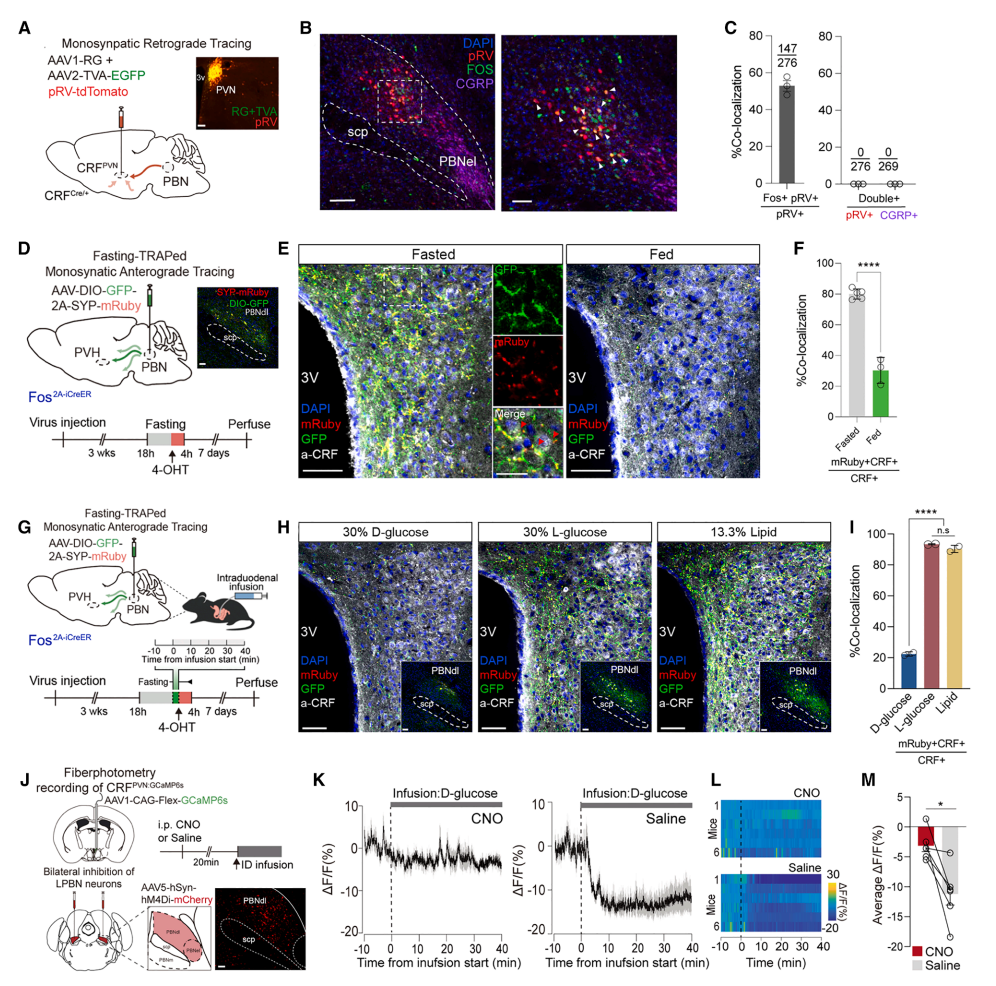
图5 PBNdl神经元亚群将肠道D-葡萄糖信息传递给CRFPVN神经元
过程:
逆行示踪:CRFPVN接受背外侧臂旁核(PBNdl)单突触输入(图5A-B)。
顺行示踪:禁食激活的PBNdl神经元投射至PVN,且D-葡萄糖输注减少其突触标记(图5D-I)。
化学遗传学验证:抑制PBNdl神经元阻断D-葡萄糖对CRFPVN的抑制(图5J-M)。
结论:脊髓-臂旁核通路介导D-葡萄糖信号神经环路进行追踪。
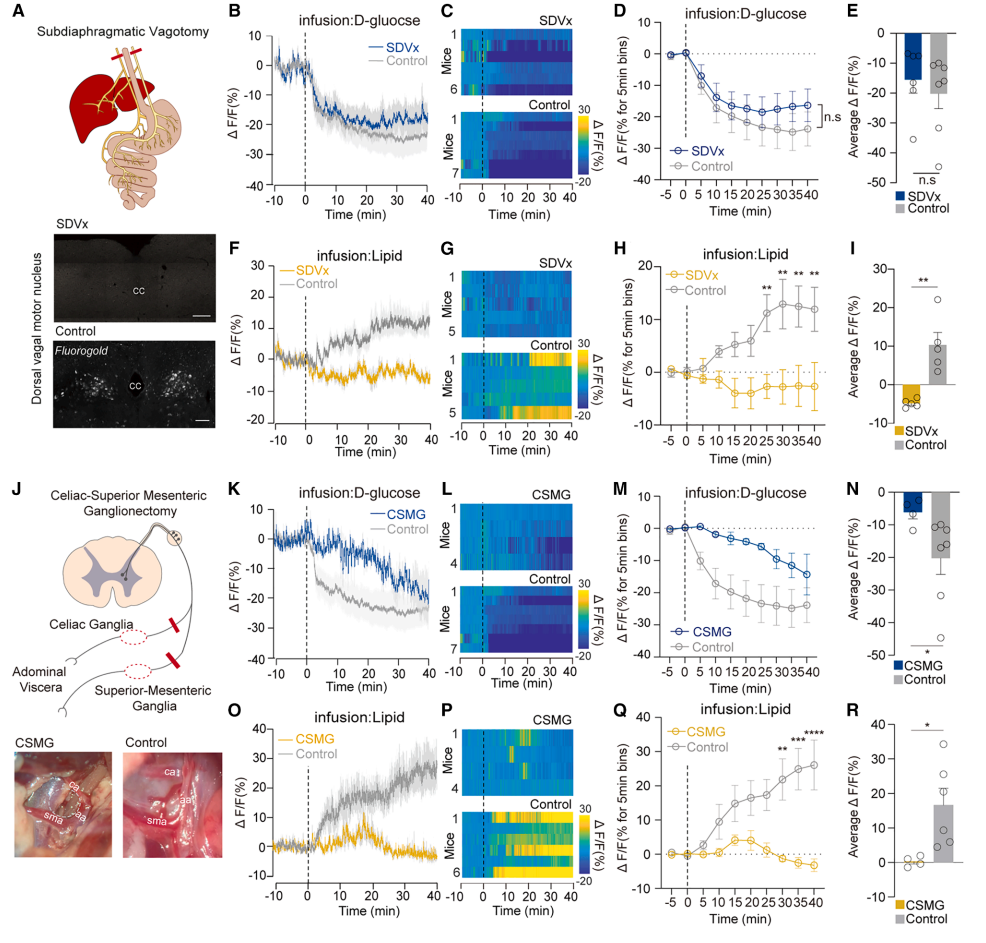
图6 不同的神经通路将肠道营养信号传递至CRFPVN神经元
过程:
迷走神经切断(SDVx):不影响D-葡萄糖的抑制效应,但阻断脂质的激活效应(图6B-I);
脊髓通路切断(CSMGx):消除D-葡萄糖抑制(图6K-N),证明其依赖脊髓传入(非迷走神经)。
结论:肠道D-葡萄糖引发的CRFPVN神经元反应需要脊髓神经,而不需要迷走神经。
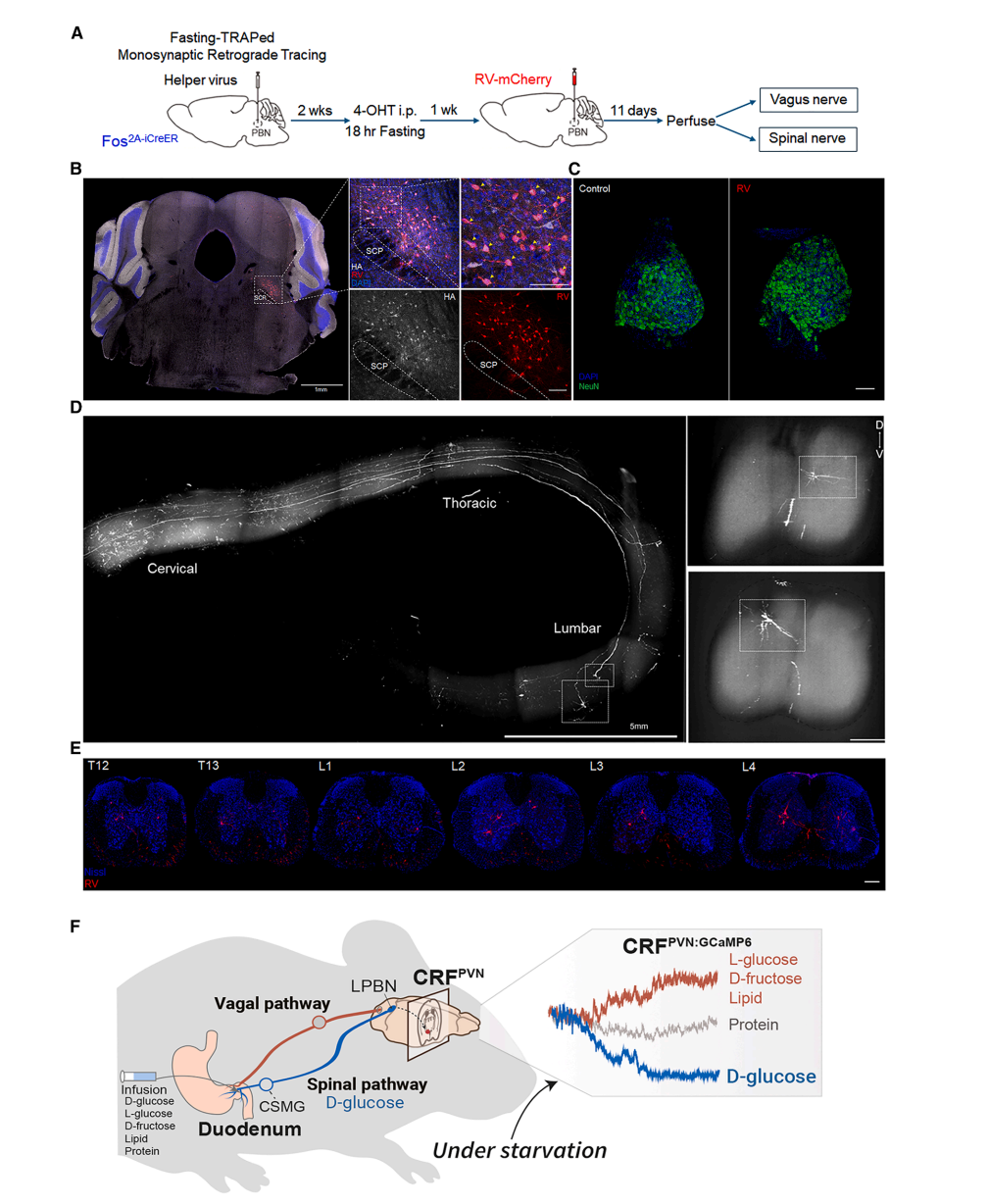
图7 禁食激活的PBNdl神经元接受脊髓输入
过程:
逆行示踪(图7A-E):
禁食激活的PBNdl神经元接受胸腰段脊髓神经元的单突触输入(图7C-E),无迷走神经标记(图7C);
模型总结(图7F):
D-葡萄糖通过脊髓→PBNdl→CRFPVN通路抑制神经元;其他营养物质(L-葡萄糖/脂质)通过迷走神经或混合通路激活神经元。
至此,一条清晰、特异的“葡萄糖身份”识别与传输通路浮出水面:肠道D-葡萄糖→(经肠细胞吸收转运)→激活脊髓内脏传入神经→抑制脑桥PBNdl神经元→抑制下丘脑CRFPVN神经元→驱动葡萄糖摄取行为。
研究意义
(1) 首次在哺乳动物大脑中鉴定出能特异性编码“D-葡萄糖身份”的神经元群及其专属的脊髓-脑桥-下丘脑通路,揭示了饥饿时精准定位“大脑救命燃料”的神经机制。
(2) CRFPVN神经元本身是应激中枢。饥饿时它们被激活以维持血糖(应激反应)。肠道D-葡萄糖通过专属通路快速抑制其活动,一方面可能缓解过度应激,另一方面直接产生“奖赏感”,驱动优先摄取。这解释了为何饿极了身体“聪明”地首选真葡萄糖。其他非脑燃料营养(如果糖、脂肪)则通过迷走神经等通路激活CRFPVN,关联“非优选”甚至应激信号。
研究延伸:MT200系统解析神经化学动态

上述文章通过电生理和成像技术揭示了葡萄糖识别的神经环路,而神经行为的完整机制还需解析化学信号传递。
北京铭泰佳信研发的活体脑化学物质实时分析系统(MT200)可实时检测脑内和血液中的葡萄糖,可为此提供关键补充,丰富科研工作者的视角:
神经化学与血糖的同步动态监测新方案
1.实时监测神经递质/调质释放:MT200系统可利用在体微透析或安培法等技术,实时、在线地监测当肠道输入D-葡萄糖、L-葡萄糖、脂肪等不同营养物质时,下丘脑PVN区、脑桥PBNdl区甚至脊髓相关区域的细胞外液中,关键神经化学物质(如DA)的动态浓度变化。这将直接揭示电活动抑制/激活背后的化学机制。
2.验证环路调控的化学机制:在光遗传/化学遗传操控CRFPVN或PBNdl神经元活动的同时,利用MT200监测目标脑区或下游脑区的化学物质释放变化,可以直接验证特定神经元活动如何调控局部或环路水平的神经化学环境,精确解析“电活动-化学释放-行为输出”的完整链条。
3.捕捉快速动力学过程:研究显示葡萄糖抑制反应在几分钟内发生。MT200的高时间分辨率(秒至分钟级)能够捕捉这些快速发生的神经化学事件,与电生理/钙成像数据同步,构建更全面的动态图谱。
4.探索病理状态:在肥胖、糖尿病或进食障碍模型中,利用MT200比较上述关键脑区在响应葡萄糖或其他营养时的神经化学信号异常,有助于揭示疾病状态下“营养感知-奖赏”环路失调的分子机制,为寻找干预靶点提供化学层面的依据。
对本研究的技术延伸
| 文章研究内容 | 活体脑化学物质实时分析系统(MT200)延伸内容 |
| 依赖间接电信号(钙成像) | 直接检测脑内葡萄糖浓度动态 |
| 无法量化血糖-脑化学关联 | 直接检测脑内葡萄糖浓度动态 |
| 未解析代谢微环境变化 | 实时监测乳酸/ATP等能量代谢物 |