
服务热线

阿尔茨海默病(AD)是最常见的痴呆类型,以Aβ和tau的渐进性聚集及随后的神经元功能障碍和认知衰退为特征。大多数研究支持抑郁是加速AD病情的重要因素,尤其在从认知正常向轻度认知障碍(MCI)及痴呆阶段转化过程中,然而抑郁促进AD病理加重的机制尚不明确。小胶质细胞作为中枢神经常驻巨噬细胞,在AD中聚集于Aβ斑块附近,既可能保护大脑,也可能因慢性激活引发神经炎症,在抑郁症中,可被应激激活,释放促炎物质。但它如何参与抑郁症加剧AD病理的过程尚不明确。Kv1.3与神经炎症相关,是AD潜在治疗靶点,Aβ通过外泌体传播,钾通道可能参与其中,AD中激活的小胶质细胞代谢转换会产生大量乳酸,可能调控基因表达。
Journal of Neuroinflammation上发表的一篇“Depression exacerbates AD pathology through lactate-dependent activationof microglial Kv1.3 to promote Aβ-containing exosome spreading”文章中表示,AD小鼠更易患抑郁,且抑郁显著增加小胶质细胞乳酸产生,加剧Aβ聚集和认知衰退。而Kv1.3可通过乳酸依赖途径被激活,对Aβ斑块周围小胶质细胞释放含Aβ外泌体至周围脑实质至关重要。值得注意的是,条件性敲除小胶质细胞Kv1.3可缓解抑郁诱导的AD病理加速。
综上,研究揭示了乳酸依赖的小胶质细胞Kv1.3激活促进Aβ扩散的新机制,该机制参与抑郁加剧AD的过程。

研究内容
1、实验模型:
(1)AD模型:5xFAD转基因小鼠(早期Aβ沉积模型)
(2)抑郁模型:通过“习得性无助”诱导抑郁行为
(3)基因敲除模型:
cKO; AD:5xFAD小鼠+小胶质细胞特异性敲除Kv1.3(通过cr1-CreER; YFP; KCNA3 fl/fl);f/f; AD:5xFAD小鼠+Kv1.3未敲除。
2、实验分组:
(1)抑郁加剧AD病理
AD-Shock:5xFAD小鼠接受电击(抑郁模型);
WT-Shock:野生型小鼠接受电击(抑郁模型);
AD-Unshock:5xFAD小鼠不接受电击(对照组);
WT-Unshock:野生型小鼠不接受电击(对照组)。
(2)小胶质细胞激活与Kv1.3表达
AD-LH⁺(抑郁阳性);
AD-LH⁻(抑郁阴性);
AD-Unshock(未电击对照)。
(3)Kv1.3敲除逆转抑郁效应
cKO; AD-LH⁺;
ff; AD-LH⁺。
(4)抑郁加速小胶质细胞糖酵解
AD-LH⁺(抑郁阳性);
AD-LH⁻(抑郁阴性);
AD-Unshock(未电击对照)。
(5)乳酸激活Kv1.3的体外验证
原代小胶质细胞:0mM/2mM/4mM乳酸
脑切片小胶质细胞:乳酸±PAP-1(Kv1.3抑制剂)
(6)乳酸通过Kv1.3加剧AD病理(体内)
ff; AD+ACSF(对照);
ff; AD+Lactate(乳酸);
cKO; AD+Lactate(乳酸 + Kv1.3 敲除)。
(7)Kv1.3介导Aβ外泌体释放
Aβ+PBS(对照);
Aβ+Lactate(乳酸);
Aβ+Lactate+PAP-1(乳酸+Kv1.3拮抗剂)。
(8)Kv1.3敲除抑制外泌体释放
cKO; AD-LH⁺;
ff; AD-LH⁺。
研究结果
1、抑郁症加剧阿尔茨海默病病理
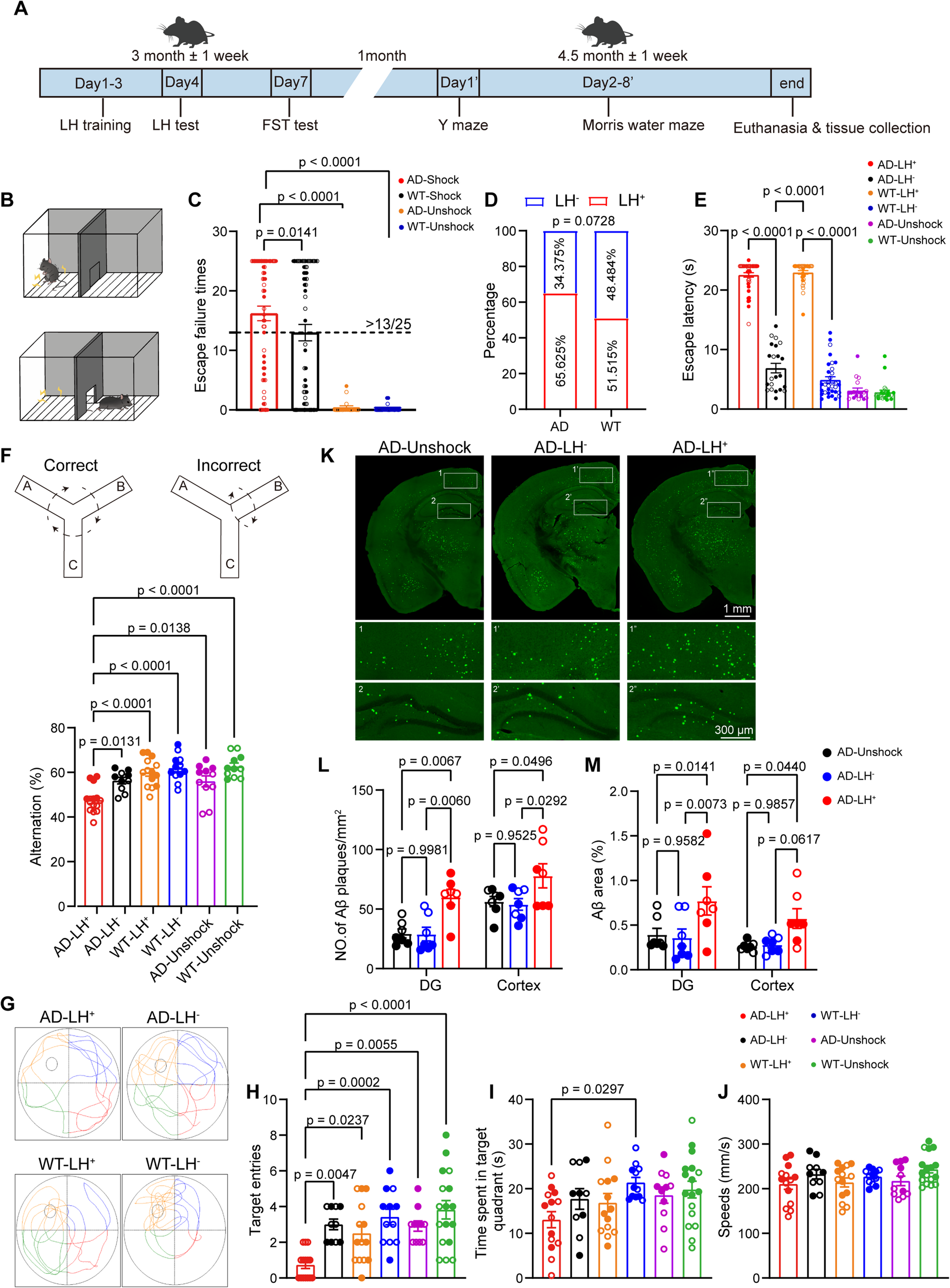
以习得性无助(LH)电击造模诱导抑郁,再用Y迷宫、Morris水迷宫测认知,硫黄素S染色看Aβ斑块,得出:AD小鼠更易抑郁,且抑郁会加剧其认知障碍(短期记忆、空间记忆变差),同时促进大脑皮层和齿状回Aβ斑块沉积,加速AD病理进程,为“抑郁加速AD发展”提供动物实验证据。
2、小胶质细胞Kv1.3参与抑郁症诱导的AD病理加剧
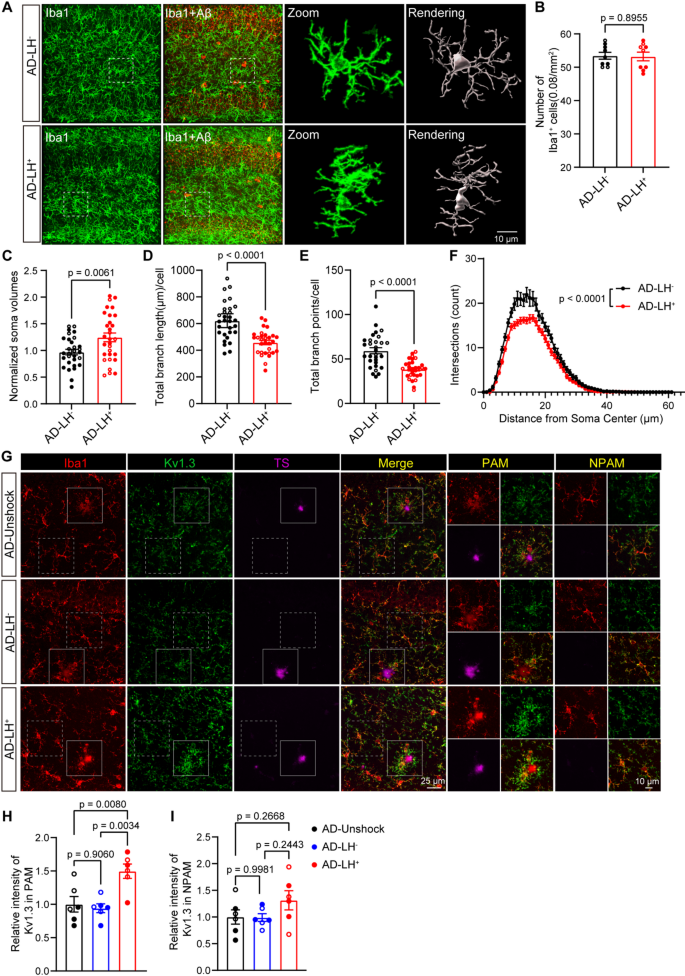
AD-LH⁺小胶质细胞分支更短、复杂度更低,呈现“促炎/吞噬功能异常”的形态特征;AD-LH⁺小鼠PAM的Kv1.3活性远高于AD-LH⁻、AD小鼠,证明:抑郁通过“激活Aβ斑块周围小胶质细胞的Kv1.3通道”,驱动AD病理加剧。
3、小胶质细胞中 Kv1.3 条件性敲除(cKO)改善抑郁诱导的AD症状加剧情况。
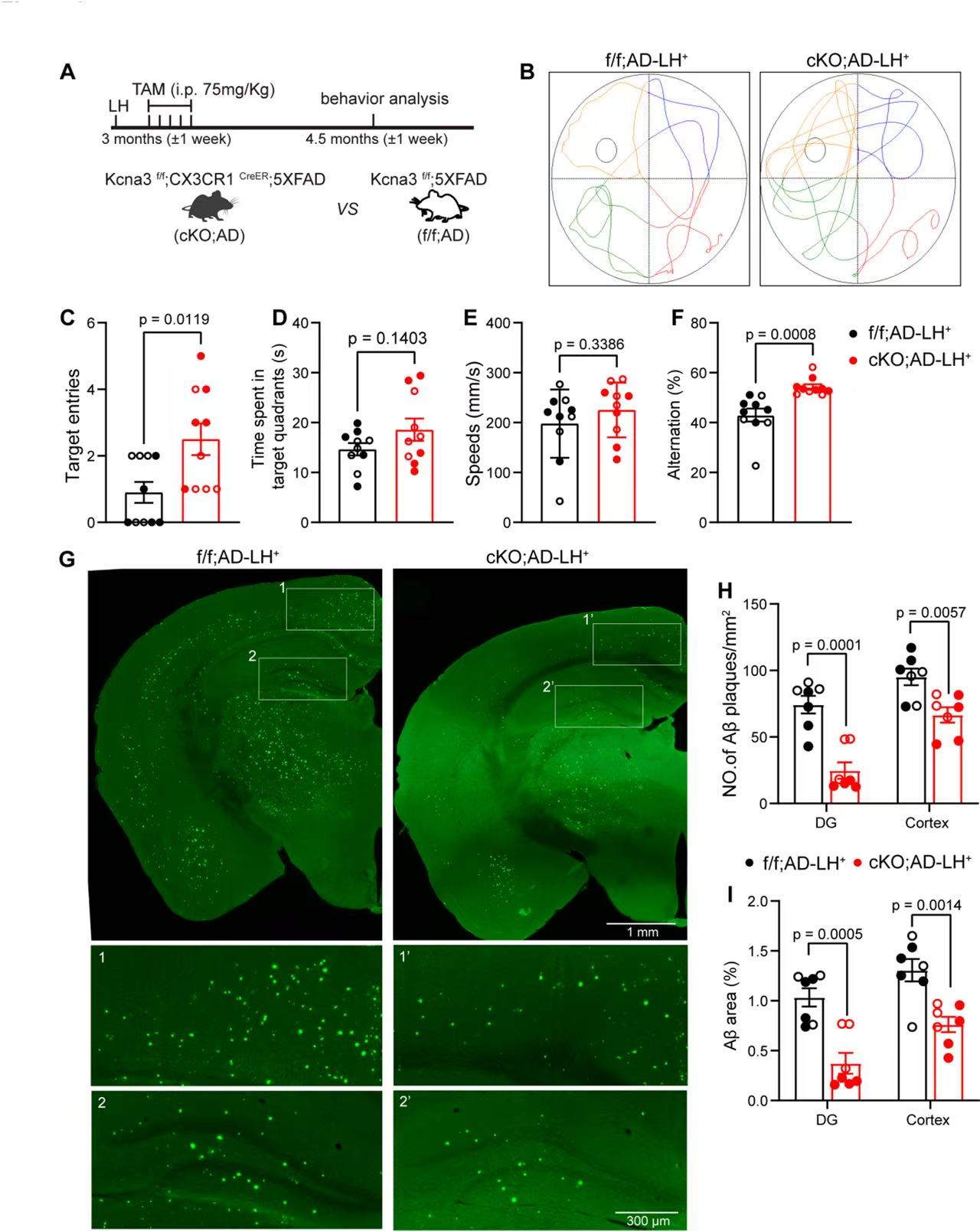
ff;AD-LH⁺小鼠自发交替率(Alternation%)显著低于cKO;AD-LH⁺小鼠,说明敲除Kv1.3后,AD-抑郁小鼠的“短期空间记忆”恢复;
cKO;AD-LH⁺小鼠“目标象限进入次数”更多、“目标象限停留时间”有延长趋势,提示空间学习记忆能力改善;
cKO;AD-LH⁺小鼠的齿状回和皮层区域,Aβ斑块数量和面积显著低于ff;AD-LH⁺小鼠,说明敲除Kv1.3可抑制抑郁诱导的Aβ沉积加剧并减少Aβ斑块的整体负荷。
4、抑郁加速 5×FAD 小鼠小胶质细胞中糖酵解相关的 PKM2 表达及乳酸积累。
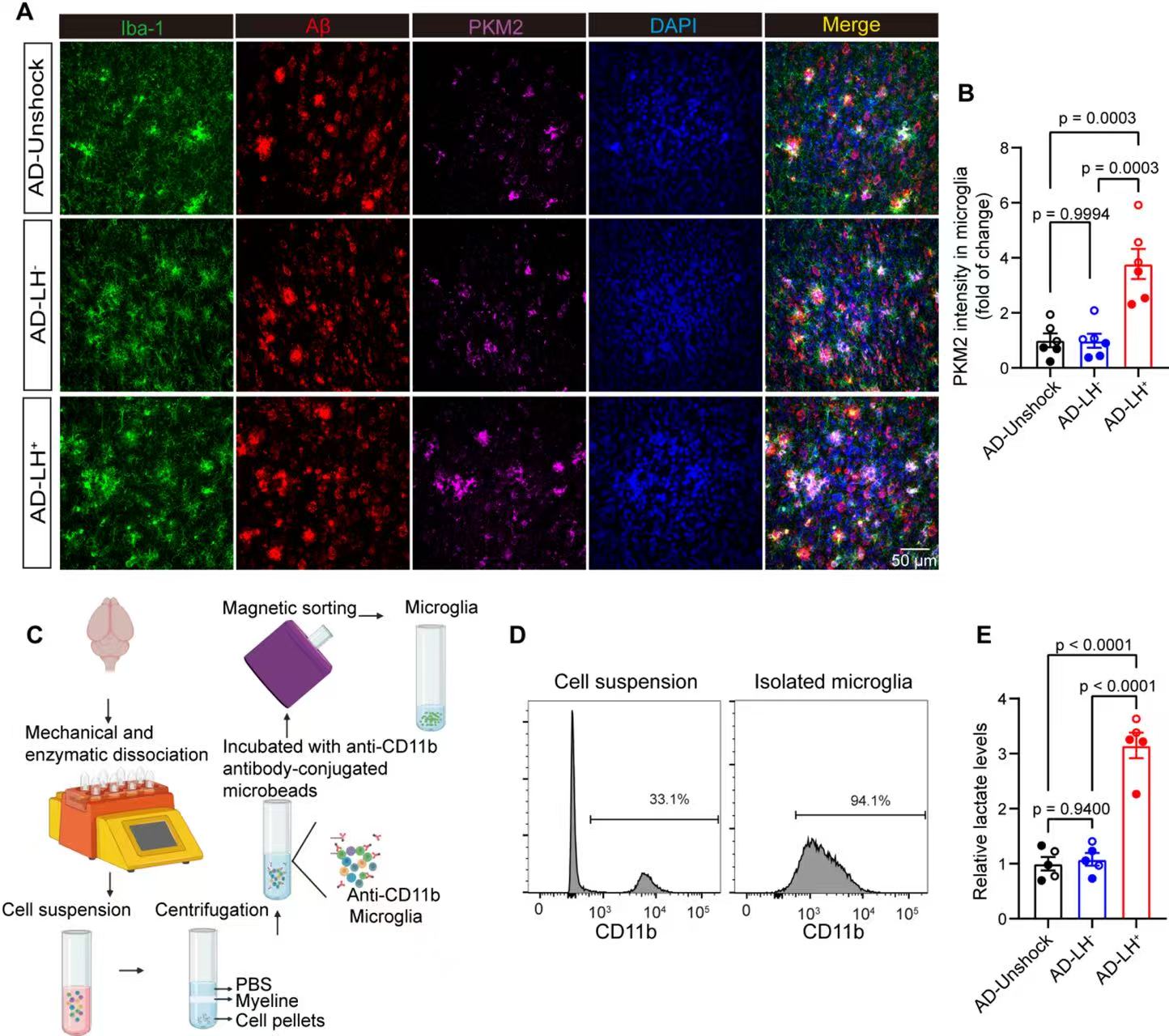
AD-LH⁺组小胶质细胞内PKM2荧光强度显著高于AD-LH⁻、AD-Unshock组,证明抑郁让AD小鼠小胶质细胞“糖酵解代谢亢进”;AD-LH⁺组小胶质细胞乳酸水平显著高于AD-LH⁻、AD-Unshock组,结合PKM2结果,说明抑郁驱动AD小鼠小胶质细胞“糖酵解→乳酸堆积”。
5、乳酸刺激可上调原代小胶质细胞中Kv1.3通道的表达并增强通道电流
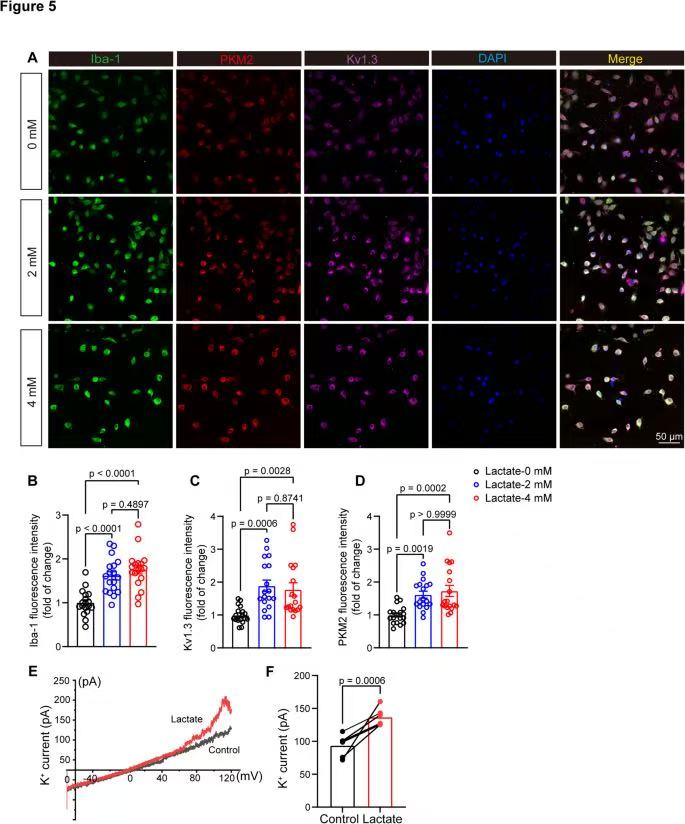
PKM2、Kv1.3随乳酸浓度升高显著增加(4mM组>2mM组>0mM组),而Iba1(小胶质细胞标记)无差异证明乳酸直接驱动小胶质细胞“糖酵解→Kv1.3通道上调”。
对于100mV电压下的钾电流,乳酸刺激组显著高于对照组,直接证明乳酸通过增强Kv1.3通道电流,激活小胶质细胞功能。
6、乳酸刺激激活脑片中小胶质细胞并增加 Kv1.3 通道开放
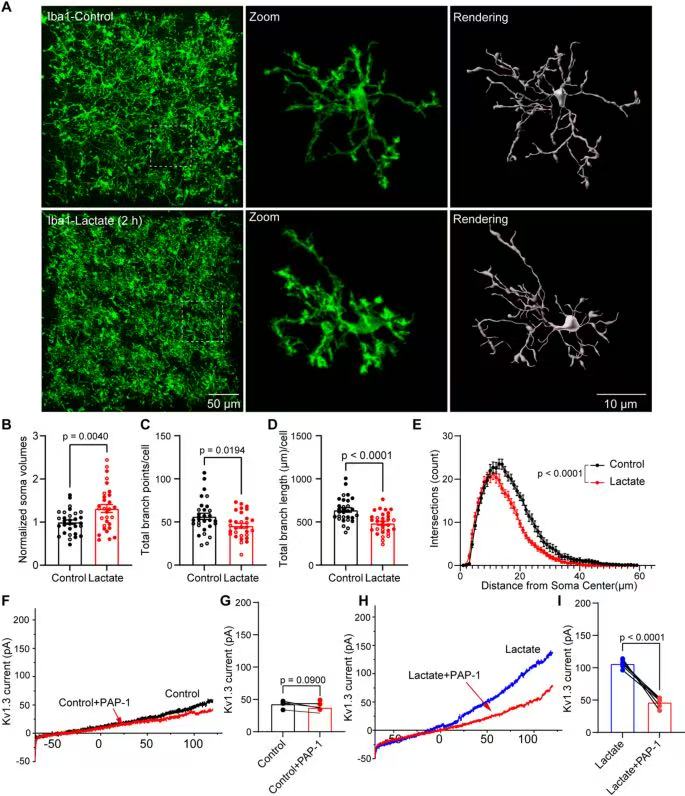
Iba1染色(绿色标记小胶质细胞)+三维重构,可见乳酸刺激(2h)后,小胶质细胞胞体体积增大,分支更短、更稀疏;100mV电压下的Kv1.3电流,乳酸组>乳酸+PAP-1组,直接验证“乳酸→Kv1.3激活”的因果关系(PAP-1阻断Kv1.3后,乳酸无法再增强电流)。
7、Kv1.3在体内介导乳酸诱导的Aβ病理变化
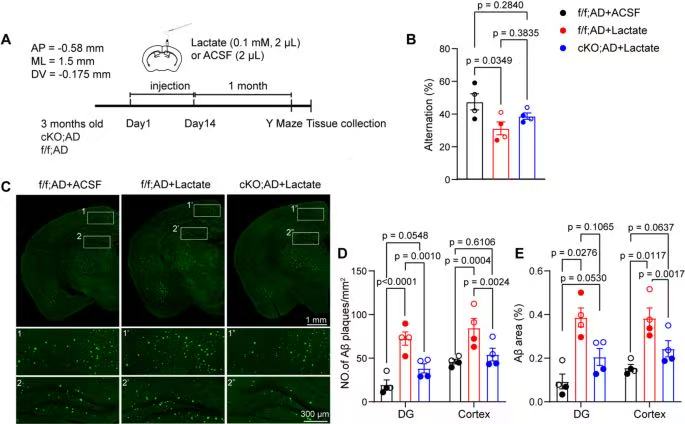
ff;AD+乳酸组自发交替率显著低于ff;AD+ACSF组(p=0.0349),证明脑内乳酸直接诱导AD小鼠认知下降;
cKO;AD+乳酸组与ff;AD+ACSF组自发交替率无差异,说明小胶质细胞Kv1.3敲除可阻断乳酸诱导的认知损伤;
ff;AD+乳酸组齿状回和皮层Aβ斑块数量显著高于ff;AD+ACSF组,证明脑内乳酸直接加速Aβ沉积;
cKO;AD+乳酸组齿状回和皮层Aβ斑块数量显著低于ff;AD+乳酸组,证明Kv1.3敲除可阻断乳酸诱导的Aβ沉积。
8、Kv1.3通道介导乳酸诱导的小胶质细胞Aβ释放
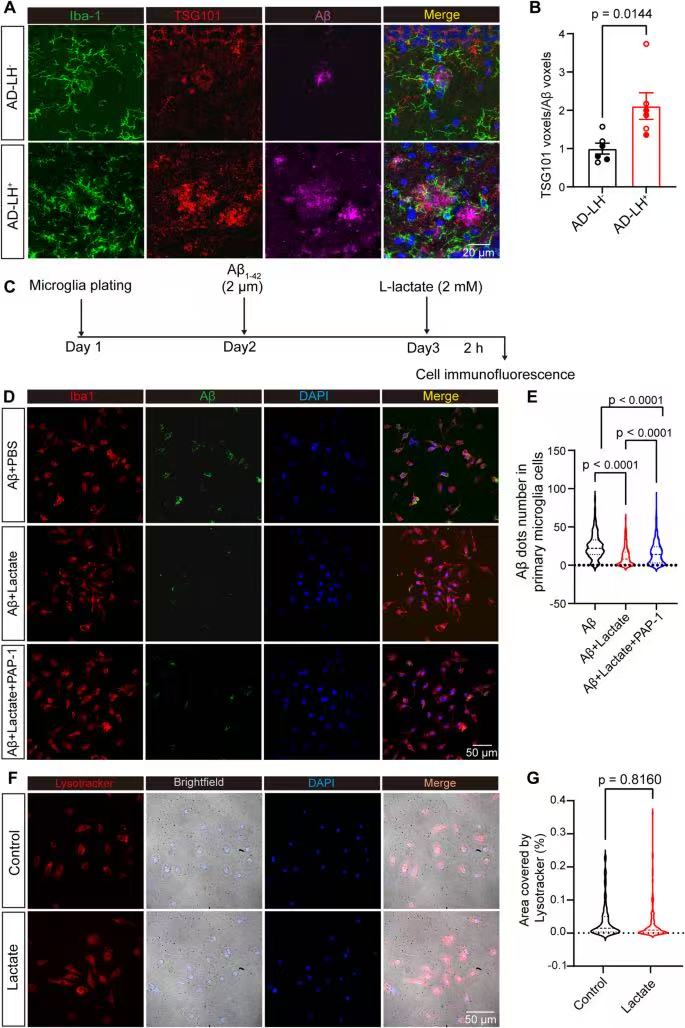
TSG101⁺/Aβ⁺共定位体积,AD-LH⁺组显著高于AD-LH⁻组,证明抑郁让AD小鼠小胶质细胞“释放更多含Aβ的外泌体”;
乳酸刺激Aβ+Lactate组后,小胶质细胞内Aβ⁺斑点显著减少;用Kv1.3拮抗剂PAP-1处理Aβ+Lactate+PAP-1组,Aβ⁺斑点又增多,证明乳酸通过激活Kv1.3,促进小胶质细胞释放含Aβ外泌体。
LysoTracker染色(红色标记溶酶体),乳酸刺激组与对照组溶酶体面积无差异,说明乳酸促进Aβ外泌体释放,不是因为溶酶体降解障碍,而是直接通过Kv1.3调控外泌体分泌通路。
9、PAP-1对Kv1.3的抑制作用可减少乳酸激活的小胶质细胞释放含Aβ的外泌体。
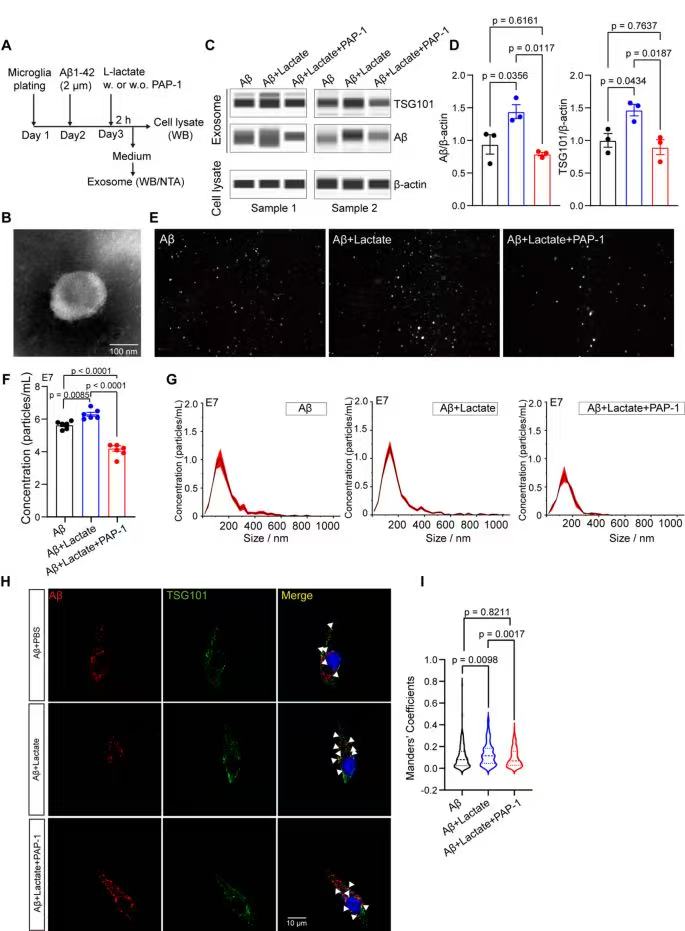
WB检测外泌体标志物TSG101和Aβ,乳酸组外泌体中TSG101、Aβ含量显著高于对照组,PAP-1处理后又降低,证明乳酸通过Kv1.3促进含Aβ外泌体释放。
NTA(纳米颗粒示踪)检测外泌体数量/大小:乳酸组外泌体浓度显著升高,且大小分布与对照组一致,说明乳酸增加外泌体“释放量”而非“改变大小”;PAP-1处理后,外泌体浓度回落,进一步验证Kv1.3的关键作用。
免疫荧光共定位(Aβ标记淀粉样蛋白、TSG101标记外泌体),乳酸组小胶质细胞外泌体与Aβ的共定位显著增加,验证“乳酸→Kv1.3→含Aβ外泌体释放”。
10、Kv1.3敲除可阻断乳酸和抑郁触发的小胶质细胞外泌体释放
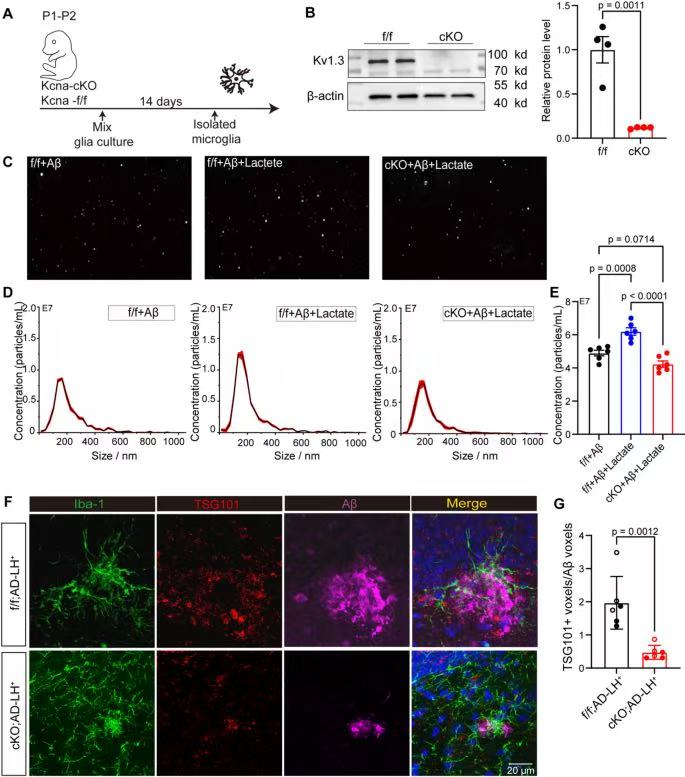
WB验证cKO小胶质细胞的Kv1.3蛋白水平显著低于未敲除(ff)组,证明敲除有效;
cKO小胶质细胞(cKO+Aβ+Lactate组)外泌体浓度显著低于ff+Aβ+Lactate组,证明Kv1.3敲除可阻断乳酸诱导的外泌体释放;
cKO组TSG101⁺/Aβ⁺共定位体积显著低于ff组,证明动物水平上,Kv1.3敲除可减少含Aβ外泌体沉积。
总结
本研究围绕抑郁症加剧阿尔茨海默病(AD)病理展开,以5×FAD小鼠(AD模型)等为对象,实验发现:抑郁症可显著加剧AD病理,使AD小鼠认知障碍更严重、Aβ斑块沉积更多;其中小胶质细胞Kv1.3是关键分子,抑郁时其在Aβ斑块附近小胶质细胞特异性激活,敲除Kv1.3可逆转抑郁诱导的AD病理;机制上,抑郁驱动AD小鼠小胶质细胞糖酵解增强、乳酸升高,乳酸非直接乳酸化激活Kv1.3,进而促进含Aβ外泌体释放、加速Aβ扩散沉积。
综上,抑郁症通过“小胶质细胞糖酵解-乳酸-Kv1.3-含Aβ外泌体”通路加剧AD病理,Kv1.3或成AD治疗潜在靶点,但乳酸激活Kv1.3的具体非乳酸化机制及Kv1.3调控外泌体释放下游步骤仍待深入研究。
活体脑化学物质实时分析系统应用

为追求更加真实的乳酸浓度,应用活体脑化学物质实时分析技术可在接近动物生理状态下观察“AD-抑郁小鼠”研究中乳酸的实时浓度。其优势体现在:
体内乳酸实时动态追踪
在Aβ斑块微环境中实时捕获“抑郁刺激-乳酸飙升-Kv1.3激活-含Aβ外泌体释放”这一完整化学链条。
精准定位,近无损检测
活体脑化学物质实时分析系统检测乳酸,针对乳酸特异电极,可实现极高灵敏度的持续感应。尖端直径120μm,长度200μm左右,实现精准定位,尽量降低对检测脑区位点损伤。
自然生理状态实时监测
活体脑化学物质实时分析系统原位检测,将电极植入到动物特定脑区,动物可在自由活动、社交、学习-记忆任务中保持自然行为,避免应激带来的乳酸假阳性,能更好地反应乳酸真实浓度变化。
药物靶点药效学评估
检测时长,乳酸可实现3天的持续检测,更便于自由控制。在Kv1.3条件敲除或药理学抑制模型中,可实时比较乳酸波动幅度和Aβ外泌体释放频率的下降程度,为靶向乳酸-Kv1.3通路的候选药物提供活体EC50和起效时间窗。
文献参考
见原文:doi.org/10.1186/s12974-025-03488-2