
服务热线

摘要
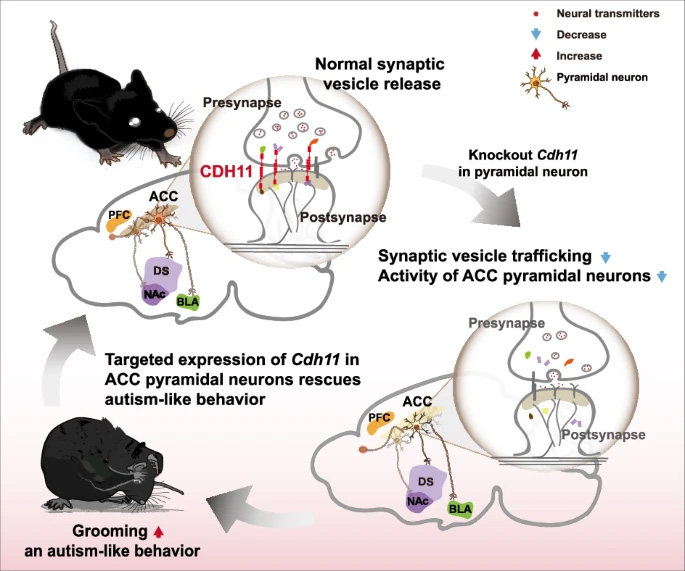
自闭症谱系障碍(ASD)众多风险基因(包括Cadherin11,CDH11)的分子病因仍不清楚。研究利用基因缺失小鼠研究CDH11在ASD相关行为发展中的作用。CDH11在前扣带皮层(ACC)谷氨酸能神经元的突触处富集,这些神经元投射至背侧纹状体(DS)、伏隔核(NAc)及基底外侧杏仁核(BLA)。在这些神经元中发育期敲除CDH11导致自我梳理增加、社交性下降,并伴随ACC神经元活动降低。化学遗传抑制ACC谷氨酸能神经元可重现过度梳理表型,而激活这些神经元则能缓解CDH11缺失小鼠的自我梳理行为。此外,在ACC靶向表达CDH11可显著减轻CDH11缺失小鼠的过度梳理。ACC突触体和CDH11互作组的蛋白质组学分析显示,CDH11参与突触囊泡运输,CDH11缺失小鼠兴奋性突触的突触前囊泡密度降低。这些发现突出了CDH11在ASD相关脑环路发育中的重要作用,并为理解ASD重复行为的分子基础提供了新见解。
引言
自闭症谱系障碍(ASD)是一种复杂的神经发育疾病,表现为社交互动受损、言语及非言语交流障碍以及兴趣受限或重复行为[1]。ASD 的病因涉及遗传、环境和神经生物学等多因素。ASD的遗传背景极为多样,大量风险基因以不同程度参与其复杂病理[2-4]。高通量基因组学研究发现了单核苷酸多态性至拷贝数变异等多种与ASD相关的遗传变异[5,6]。这些基因参与神经发生、神经元迁移、轴突和树突发育及突触形成等过程[7-10]。值得注意的是,许多风险基因在与ASD行为和功能密切相关的脑区(如前额叶皮层、杏仁核、纹状体、海马和小脑)中显著表达[1,11],提示基因异常与ASD行为表型之间存在潜在机制联系。这些基因在与ASD相关的脑区中的汇聚表达,提示可能存在一条共同通路或环路,其受损导致ASD特征性表现[12-14]。
一类高置信度的ASD风险基因编码突触黏附分子,例如钙黏蛋白(cadherins)、神经配蛋白(neuroligins)、神经连接蛋白(neurexins)及接触素相关蛋白[15,16],突显突触黏附分子在发育和功能中的关键作用。突触黏附异常可导致突触连接改变,进而可能导致ASD的行为和认知症状。钙黏蛋白家族成员Cadherin11(CDH11)被认为是ASD相关基因[17-20]。CDH11编码II型经典钙黏蛋白,介导同源细胞间黏附。遗传学研究强调CDH11基因突变在精神疾病和情感障碍(包括ASD、双相障碍、精神分裂症和重度抑郁障碍)中的重要作用[21,22],提示其对脑发育和功能的广泛影响。然而,以往研究主要关注CDH11在癌症和免疫系统中的作用,探讨其在细胞黏附、迁移、肿瘤进展和炎症反应中的功能[23]。
实验研究表明CDH11在脑发育中具有重要作用。ASD患者来源神经元培养中观察到CDH11异常表达[18]。CDH11与CDH9在小脑ASD相关区域的浦肯野细胞亚群中呈互补高表达,提示其参与ASD过程[11]。敲低CDH11可损害神经元培养中的突触发育[24]。CDH11基因敲除小鼠表现出类似自闭症的行为缺陷,包括社交性降低、自我梳理增加和运动协调受损[17,25]。然而,CDH11突变如何导致ASD相关行为缺陷的分子和环路机制仍不清楚。
上海市脑功能基因组学教育部重点实验室、华东师范大学生命科学学院脑功能基因组学研究所、华东师范大学脑科学协同创新中心袁小兵、潘逸萱团队在Molecular Psychiatry发表“Cadherin 11 regulates presynaptic vesicle trafficking and neuronal activity in autism-related brain circuit”文章,研究采用多学科方法,利用CDH11缺失小鼠探讨CDH11如何影响ASD相关脑环路的发育和功能。研究发现CDH11在ASD相关脑区(如ACC)的突触处富集,并对突触前囊泡运输至关重要,其功能缺陷导致重复行为。为理解ASD重复行为的分子机制提供了新见解。

CDH11在ASD相关脑区及环路中的表达
首先利用原位杂交检测CDH11在小鼠脑中的发育表达谱。发现CDH11在ASD发病关键脑区(ACC、纹状体和海马)中高度表达,表达时期涵盖胚胎第17.5天(E17.5)及出生后第5、14天(P5、P14)(图1A)。免疫荧光染色结合荧光原位杂交(FISH)显示,CDH11信号在ACC和海马的Neurogranin阳性锥体神经元中强烈表达,而在GAD67阳性GABA能神经元中信号极弱(图1B和C)。将CDH11-flox小鼠与Emx1-Cre小鼠杂交,获得前脑锥体细胞系特异性敲除(EcKO)小鼠,发现Neurogranin阳性细胞中的CDH11 FISH信号显著降低(图1B和C),提示CDH11主要表达于这些区域的兴奋性谷氨酸能神经元。
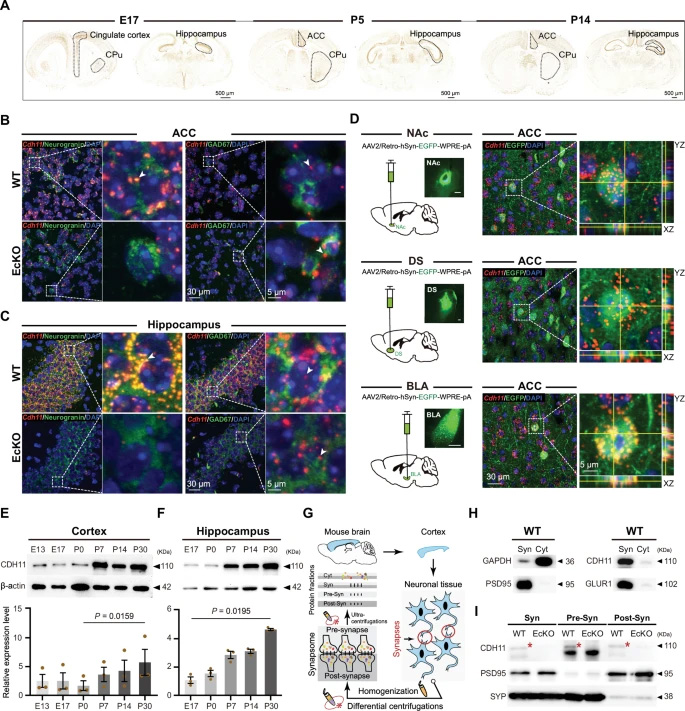
图1:CDH11在自闭症相关脑区和脑回路中的表达
鉴于ACC与DS、NAc和BLA等ASD关键脑区的连接[26,27],利用AAV2/Retro-hSyn-EGFP进行逆行追踪,发现ACC投射至这些区域的神经元中均有CDH11 mRNA表达(图1D)。
Western blot分析显示,小鼠皮层和海马中CDH11蛋白水平自P7起显著增加(图1E和F),提示其参与出生后突触形成和树突棘修剪等关键发育过程。进一步利用蔗糖密度梯度离心分离突触体,发现CDH11富集于突触体,并同时存在于突触前膜和突触后膜(图1G-I)。EcKO小鼠的突触前膜和突触后膜中CDH11缺失,证实其表达特异性(图1H和I)。
人类发育脑组织中,与CDH11共表达基因的GO分析显示其在“突触组装调控”“轴突延伸正调控”“树突发育调控”及“细胞黏附”等通路中显著富集(补充图2;补充表1,见原文)。综上,CDH11作为同源黏附分子,可能在ASD相关脑区及环路的突触结构形成和维持中发挥关键作用。
CDH11缺失小鼠表现出自我梳理增加和社交性降低
之前的研究发现CDH11缺失小鼠表现出ASD核心行为缺陷,包括自我梳理显著增加和社交性降低[17]。为验证CDH11缺失对ASD相关行为的影响并解析其分子和环路机制,研究利用Cre/loxP系统,在特定发育阶段及特定神经元亚群中敲除CDH11。将CDH11-flox小鼠分别与Vasa-Cre、Emx1-Cre、CamKIIα-Cre和Dlx5/6-Cre小鼠杂交,获得一般基因敲除(KO)、从早期胚胎阶段开始的前脑锥体系特异性条件基因敲除(EcKO)、成年前脑锥体神经元特异性条件性基因敲除(αcKO)和从早期胚胎阶段开始的皮层GABA能神经元特异性条件性基因敲除(DcKO)小鼠(图2A和B)。Western blot显示KO、EcKO和αcKO小鼠皮层和海马中CDH11蛋白显著降低,而DcKO小鼠无变化(图2C和D),与CDH11在锥体神经元中的高表达一致(图1B和C)。
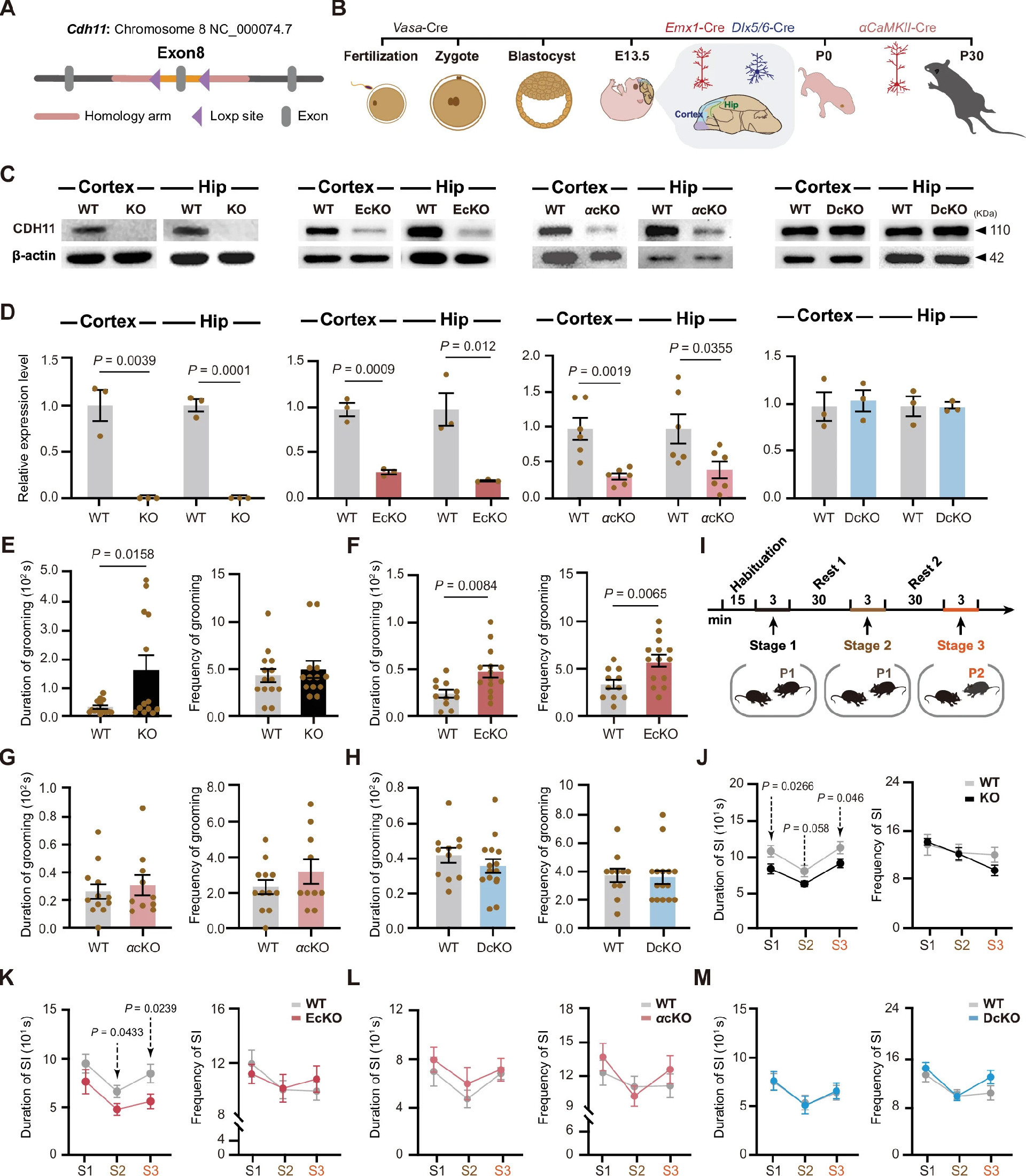
图2:CDH11基因缺陷小鼠的自我梳理能力增强,社交能力降低
与之前研究一致,新构建的KO小鼠表现出自我梳理时间显著增加(图2E)和三阶段社交测试中社交互动异常(图2I和J)。EcKO小鼠亦表现出自我梳理增加和社交缺陷(图2F和K),而αcKO和DcKO小鼠无此表型(图2G、H、L和M),提示CDH11在前脑锥体细胞系发育过程中的功能缺失导致重复行为和社交缺陷。此外,KO和EcKO小鼠水喷雾诱导的梳理行为与野生型无显著差异(补充图3A-C),提示其外周感觉正常,过度梳理非感觉异常所致。
除ASD核心症状外,EcKO小鼠在恐惧条件化实验中对听觉线索的恐惧反应降低,而对情境线索无显著变化;αcKO小鼠无此异常(补充图3D-F)。开放场实验中,EcKO和αcKO小鼠总运动量和中央探索时间正常(补充图3G-K)。
为确定CDH11缺失导致自我梳理增加的关键时期和脑区,研究将AAV2/9-CaMKIIα-Cre-EGFP病毒注入CDH11-flox小鼠ACC,分别在P0、P7和P30时特异性敲除ACC锥体神经元中的CDH11(图3A-D),成年后进行行为测试。发现P0或P7时敲除CDH11可导致自我梳理时间和频率增加(图3E-H),而P30时敲除无行为改变(图3I和J)。P0时敲除对恐惧反应和社交行为无显著影响(补充图4A-D)。
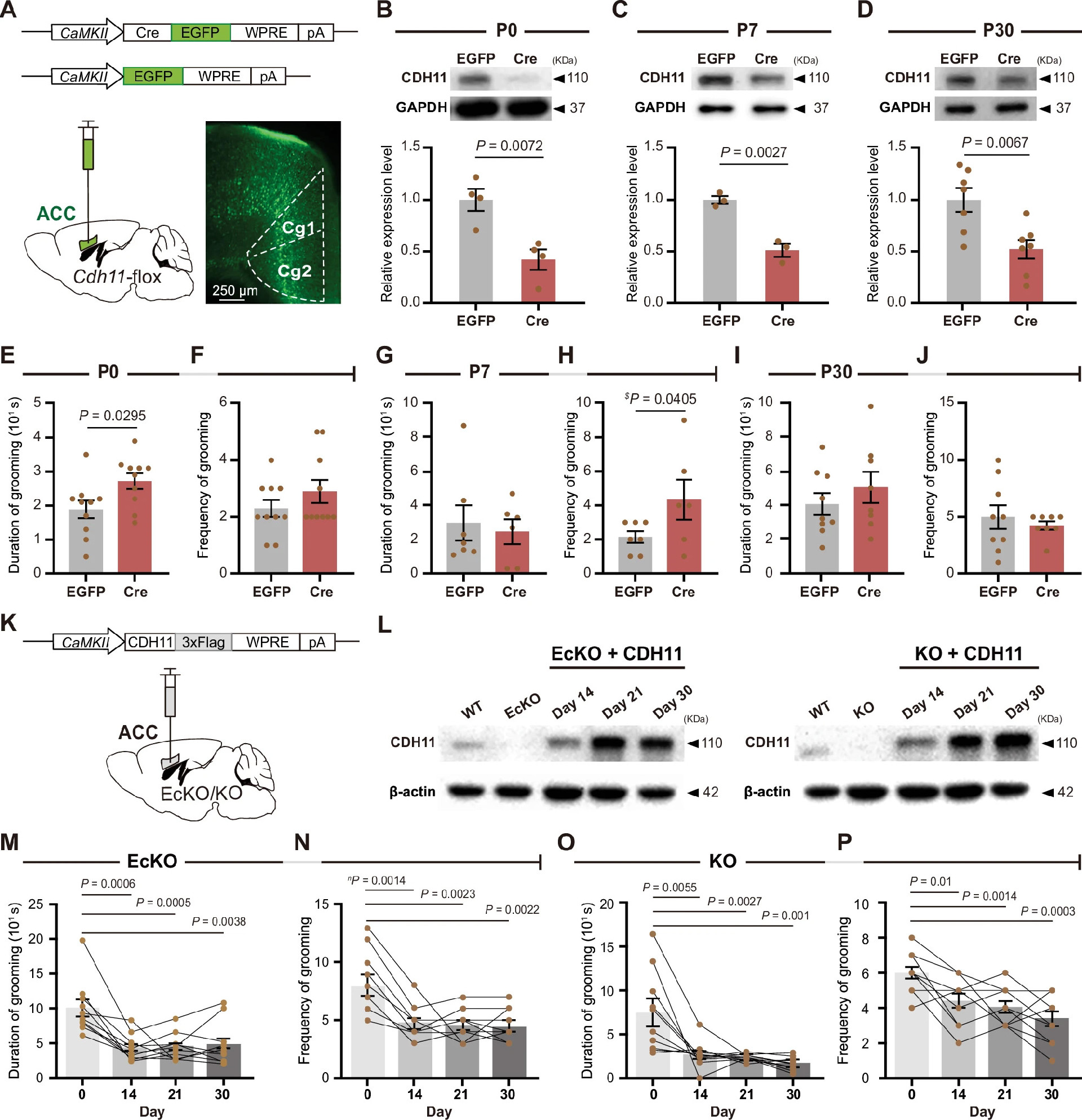
图3:CDH11基因敲除小鼠ACC中CDH11的补体
为验证CDH11恢复能否逆转表型,研究将AAV2/9-CaMKIIα-CDH11-3xFlag注入8周龄KO和EcKO小鼠ACC(图3K和L)。成年ACC锥体神经元中靶向表达CDH11显著降低自我梳理时间和频率(图3M-P),表明ACC区CDH11表达足以缓解重复行为,强调CDH11在ACC锥体神经元发育中的重要作用。
CDH11缺失小鼠ACC神经元活动异常
利用即刻早期基因c-Fos检测突变小鼠自我梳理时的神经元活动(图4A)。发现EcKO小鼠ACC中c-Fos阳性细胞显著减少(图4B和C),而BLA、DS和NAc中无显著变化(图4D-H),提示ACC神经活动降低与刻板行为出现相关。
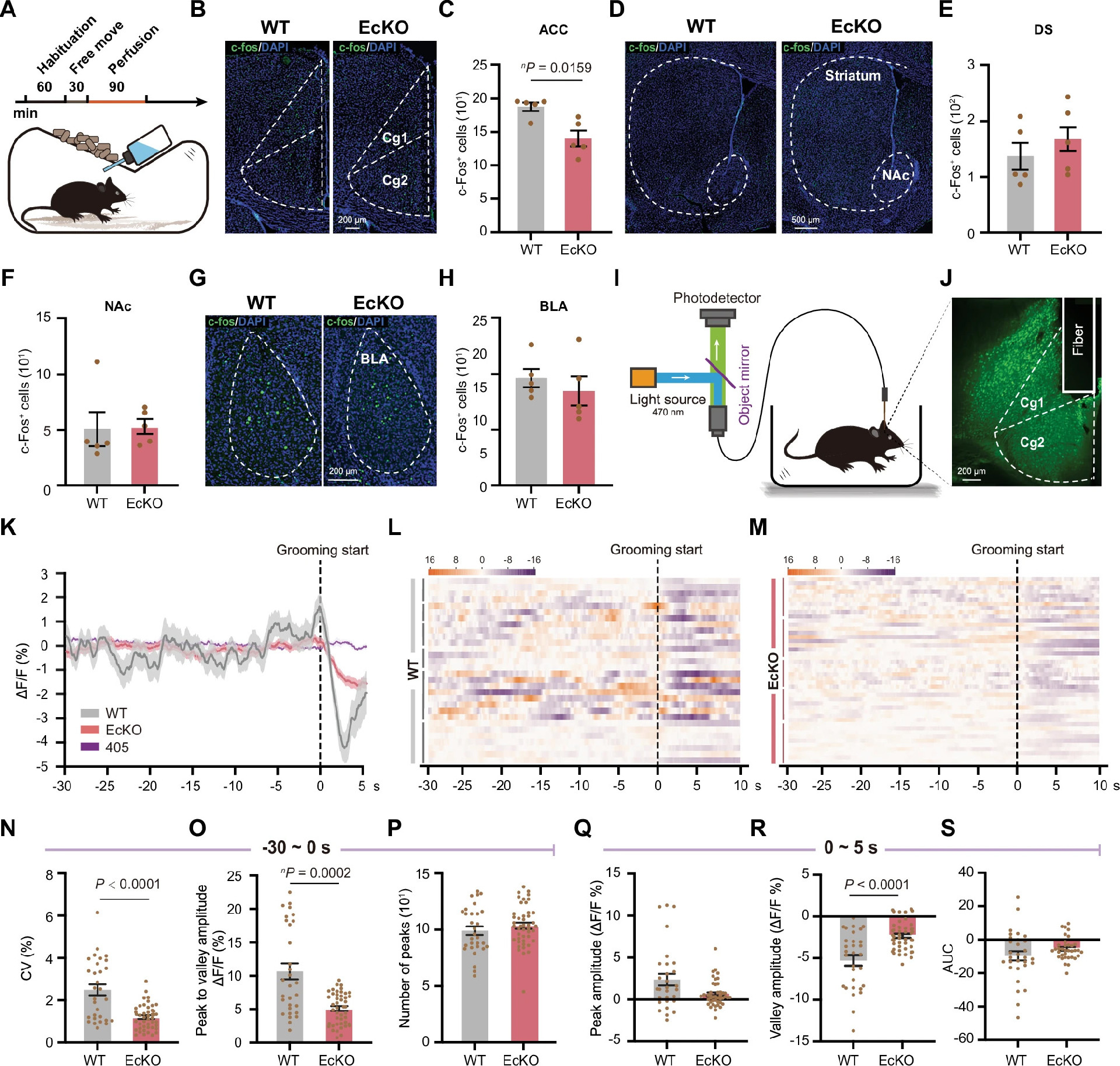
图4:CDH11缺失小鼠ACC中异常的神经元活动
光纤记录技术监测WT小鼠ACC锥体神经元在自我梳理前后的钙信号,发现梳理开始时钙信号显著下降(图4K)。比较WT和EcKO小鼠ACC锥体神经元钙活动,发现EcKO小鼠梳理前钙信号波动幅度显著低于WT(图4N-P),且梳理开始时钙信号下降幅度较小(图4R),提示ACC神经元活动动态与梳理持续时间相关,CDH11缺失导致ACC神经网络活动减弱,可能增强刻板行为。
化学遗传操控ACC活动改变自我梳理行为
在WT小鼠ACC锥体神经元中表达抑制性DREADD hM4Di,CNO处理后显著增加自我梳理时间(图5A-I),表明降低ACC锥体神经元活动可促进重复行为。相反,化学遗传激活ACC锥体神经元(hM3Dq)显著减少WT、EcKO和KO小鼠梳理行为(图5S-U)。
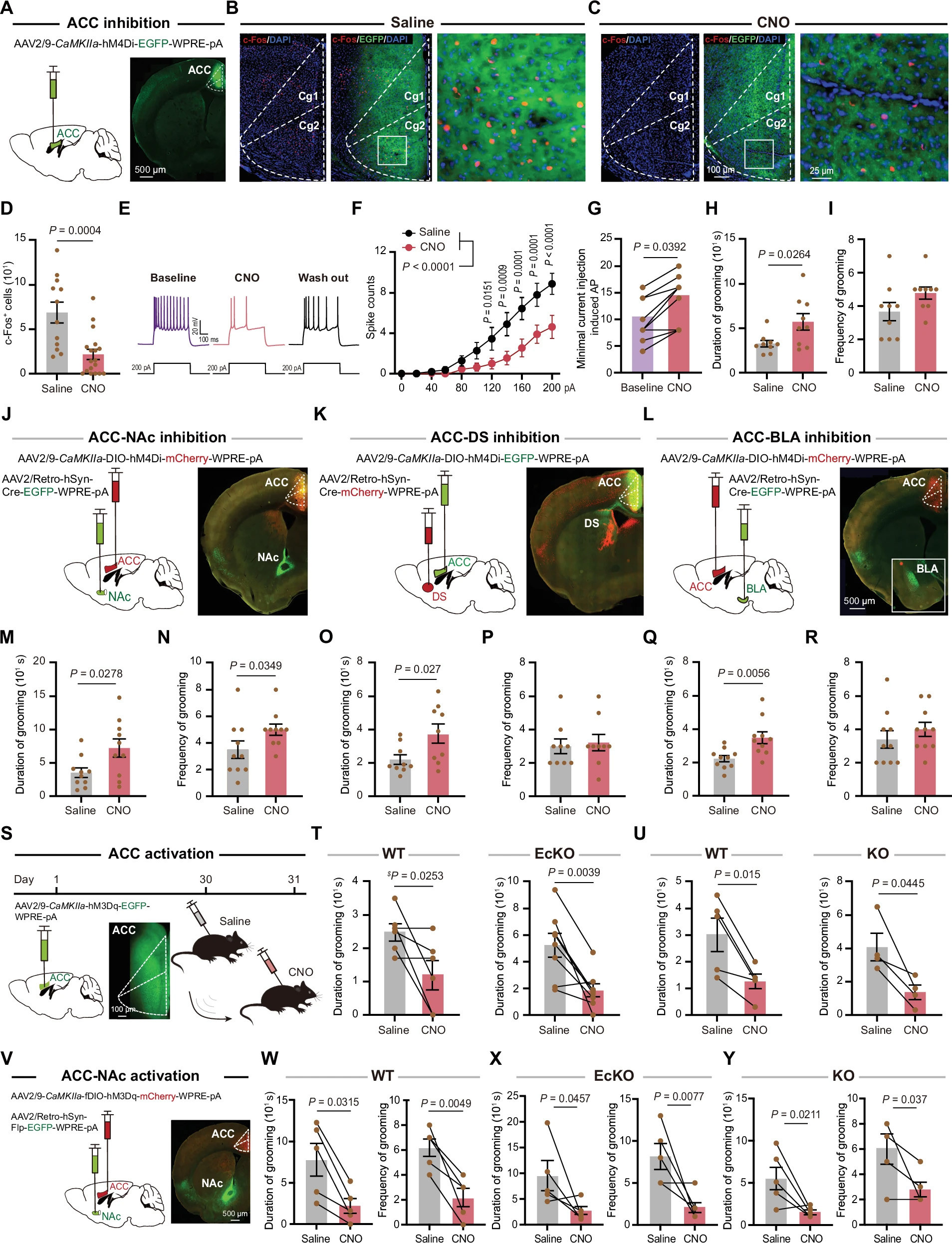
图5:化学遗传学操纵ACC活性会改变自我疏导
CDH11在ACC锥体神经元中表达,并投射至NAc、DS和BLA。选择性抑制ACC至这些区域的投射,发现抑制ACC-NAc投射显著增加梳理时间和频率,而抑制ACC-DS和ACC-BLA投射仅增加梳理时间(图5M-R)。激活ACC-NAc投射显著降低WT、EcKO和KO小鼠梳理行为(图5V-Y)。
多层蛋白质组学揭示CDH11在突触囊泡回收中的关键作用
为解析CDH11缺失导致ACC活动降低的分子机制,研究比较成年EcKO与WT小鼠ACC蛋白质组,发现286个差异表达蛋白,其中159个下调,127个上调(图6A和B)。GO分析显示,下调蛋白富集于“囊泡”“囊泡膜”“囊泡介导的运输”等(图6A)。Western blot证实EcKO小鼠ACC中MAGI2显著下调,VTI1A呈上调趋势(图6C和D)。
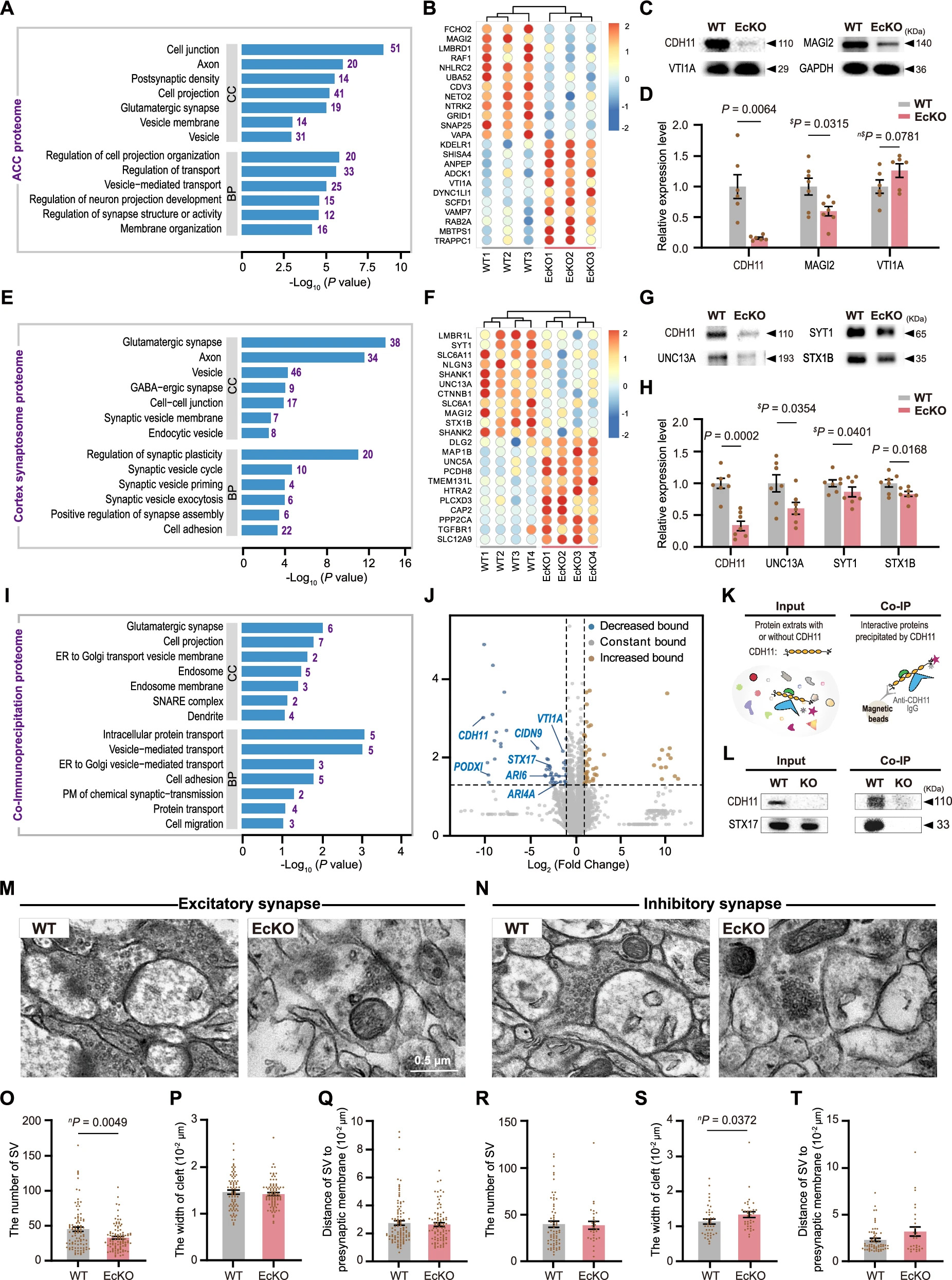
图6:多层蛋白质组学和超微结构分析揭示了CDH11在突触囊泡再循环中的关键作用
进一步分析皮层突触体蛋白质组,发现354个差异蛋白,232个下调,122个上调(图6E和F)。GO分析显示下调蛋白富集于“突触囊泡循环”“突触囊泡启动”“突触囊泡胞吐”等(图6E)。Western blot证实EcKO小鼠突触体中UNC13A、SYT1和STX1B显著下调(图6G和H),提示CDH11主要调节谷氨酸能突触的突触囊泡动态。
进一步利用免疫共沉淀鉴定P7皮层中与CDH11互作的蛋白,发现50个互作蛋白(图6I-K)。GO分析显示这些蛋白富集于“囊泡介导的运输”“ER到高尔基体囊泡运输”“SNARE复合体”等(图6I)。Western blot证实CDH11与膜融合关键蛋白STX17相互作用(图6L)。
综上,多层蛋白质组学分析提示CDH11在出生后大脑皮层发育过程中,对谷氨酸能突触的囊泡运输发挥关键作用。
CDH11缺失降低兴奋性突触突触前囊泡密度,增加抑制性突触间隙宽度
研究发现CDH11缺失对皮层分层无显著影响,对ACC锥体神经元树突发育和树突棘形成影响极小(补充图7和8)。鉴于CDH11缺失显著影响突触组分(图6),利用透射电镜观察EcKO与WT小鼠ACC兴奋性和抑制性突触超微结构,发现EcKO小鼠兴奋性突触(突触后致密较厚的不对称突触)突触前囊泡数量显著减少(图6M和O),而抑制性突触(突触后致密较薄的对称突触)无显著变化(图6N和R)。兴奋性突触囊泡与突触前膜距离无显著变化(图6Q),但抑制性突触间隙显著增宽(图6S),兴奋性突触间隙无变化(图6P)。综上,CDH11对哺乳动物前脑突触囊泡回收至关重要。
讨论
本研究揭示CDH11在ASD相关脑环路关键神经元群体突触发育中的关键作用。利用多种基因敲除和条件敲除小鼠模型,揭示了CDH11影响ASD相关重复行为的分子和细胞机制。
CDH11在ASD相关环路发育中的表达与作用
研究发现CDH11在ASD关键脑区(ACC、纹状体、海马)中高表达,主要表达于Neurogranin阳性锥体神经元。前脑锥体细胞系特异性敲除(EcKO)导致CDH11表达显著降低。尽管CDH11在其他细胞类型中也有表达,但EcKO小鼠皮层CDH11蛋白水平显著降低,且表现出ASD核心行为缺陷,提示CDH11缺失导致的自闭症表型主要归因于其在前脑锥体神经元发育中的作用。
钙黏蛋白家族成员通过介导同源性或异源性细胞间相互作用,在细胞增殖、极化、神经元迁移、轴突投射、树突分支和突触组装等多个发育过程中发挥重要作用。CDH11表达在胚胎大脑皮层发育中随细胞退出脑室区而上调,过表达可导致神经元过早退出神经上皮并增加细胞迁移[38]。然而,本研究和之前研究均未见皮层分层缺陷(补充图7),提示CDH11可能在皮层锥体神经元放射状迁移或分层中作用不显著。CDH11在P7后表达显著增加,提示其在出生后发育(尤其是突触组装)中具有重要作用,这与蛋白质组学和电镜研究结果一致。此项研究提示突触缺陷是CDH11缺失小鼠行为缺陷的主要原因,但CDH11在发育过程中轴突生长和导向中的潜在作用尚不能排除。
CDH11缺失的行为学意义
行为分析显示,全身性和前脑锥体细胞系特异性敲除CDH11的雄性小鼠表现出自我梳理增加和社交缺陷,而成年特异性或GABA能细胞系特异性敲除无此表型,提示CDH11在特定发育时期锥体神经元中的关键作用。除ASD核心症状外,EcKO小鼠恐惧反应降低,与之前研究一致[25]。多种ASD小鼠模型亦观察到异常恐惧反应[39,40]。CDH11缺失小鼠表现出多种核心和共病症状,进一步支持CDH11是ASD重要风险基因,这些小鼠可作为研究ASD神经机制的重要动物模型。
尽管ASD由发育缺陷引起,之前研究表明在青少年或成年期恢复ASD风险基因(如Shank3[41]、MECP2[42]、Ube3a[43]、Nlgn3[44]和SCN2A[45])可挽救小鼠自闭症行为。值得注意的是,研究发现成年(8周龄)EcKO和KO小鼠ACC靶向表达CDH11可有效缓解过度梳理行为,提示成年期通过系统性基因治疗靶向CDH11可能缓解ASD相关症状,值得未来研究进一步探讨。
ACC是大脑高级调控中枢,在情绪、决策、学习和动机等基本认知过程中发挥重要作用[46]。ACC功能异常与刻板行为及异常恐惧和焦虑密切相关[47–49]。ACC锥体神经元与其他脑区广泛互连,形成复杂神经网络。此项研究为CDH11在ACC锥体神经元发育和功能中的重要作用提供了大量证据,其缺失导致显著的神经发育和行为异常,表现出ASD特征。
研究发现P0时ACC锥体神经元中CDH11缺失诱导过度梳理,但未导致社交缺陷或异常恐惧反应,提示ACC主要调节重复行为,而海马[50]和BLA[48]等其他脑区可能分别参与社交和情绪异常。CDH11在这些区域是否发挥类似作用尚待确定。此外,本研究所有行为分析均在雄性小鼠中进行,未来应探讨CDH11缺失的性别依赖性效应。
神经元活动和环路改变
研究发现成年EcKO小鼠ACC中c-Fos阳性细胞减少,钙信号波动减弱,提示神经网络活动降低。之前研究发现dmPFC投射至DS的神经元在小鼠自我梳理开始时钙活动显著下降[51]。本研究发现WT和EcKO小鼠ACC钙活动在梳理开始时均显著下降,但EcKO小鼠钙活动波动显著小于WT。电镜亦发现EcKO小鼠ACC谷氨酸能突触囊泡显著减少,可能导致网络活动降低。与之一致,之前研究发现CDH11缺失小鼠海马神经元活动和同步性显著降低[25]。
除突触前组装异常外,此项结果不排除突触后改变对ACC神经元活动降低的贡献。蛋白质组学研究显示突触后组分(如GABRA3和EPHA4)表达改变,抑制性突触间隙增宽,而兴奋性突触无此异常。由于EcKO小鼠ACC锥体神经元抑制性突触仅突触后缺失CDH11,而兴奋性突触双侧缺失,推测单侧缺失可能导致突触间隙显著增宽,而双侧缺失可能通过其他黏附分子补偿维持兴奋性突触间隙宽度。此项结果强调CDH11在ACC锥体神经元兴奋性突触输入中的重要作用。未来研究CDH11在ACC锥体神经元输出突触发育和功能中的作用及其对社交和重复行为的影响,将有助于全面理解其在脑发育和疾病中的功能。
CDH11突触前功能的分子机制
与EcKO小鼠ACC神经元活动降低一致,研究发现其ACC谷氨酸能突触超微结构缺陷。CDH11蛋白富集于突触体,分布于突触前膜和突触后膜。EcKO小鼠皮层差异表达蛋白显著富集于突触囊泡运输相关通路,提示CDH11在突触囊泡动态中的作用。关键CDH11互作蛋白涉及囊泡介导的运输,进一步支持其在突触囊泡运输中的作用。电镜分析显示兴奋性突触突触前囊泡显著减少,直接将CDH11缺失与突触囊泡运输受损联系起来,提示其在突触传递和可塑性中的关键作用。与之一致,之前研究发现CDH11缺失小鼠海马脑片LTP饱和水平显著降低[25]。这些结果强烈提示CDH11缺失导致谷氨酸能突触囊泡循环缺陷,从而影响ACC神经网络活动。
之前研究表明CDH2(N-cadherin)与神经配蛋白-1(NLGN1)相互作用,通过促进突触囊泡内吞,跨突触增强突触前囊泡回收和聚集[52–54]。有趣的是,研究发现EcKO小鼠突触体中NLGN3显著下调(补充表3,见原文)。此外,在CDH11互作蛋白中鉴定到自噬体SNARE蛋白STX17(补充表4,见原文)。由于STX17与SNAP29和内体/溶酶体SNARE VAMP8相互作用,调控囊泡融合和内吞[55],提示CDH11可能通过类似CDH2的分子机制调节ACC锥体神经元突触前囊泡组装。我们的发现提示突触囊泡运输缺陷是ASD环路和行为缺陷的关键细胞机制,可能成为ASD的潜在干预靶点。
总之,研究发现CDH11在ASD相关脑环路发育和功能中发挥重要作用,其缺失导致显著行为缺陷和突触异常,可能与其在突触发生过程中囊泡运输中的重要作用有关。理解CDH11缺陷如何导致ASD核心症状的分子机制,将为纠正这一缺陷的潜在策略提供宝贵见解。